题目内容
10.砷为33号元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | 可以存在-3、+3、+5等多种化合价 | D. | As2O5对应水化物的酸性比H3PO4弱 |
分析 A.根据同主族元素的单质性质的相似性判断;
B.同主族元素从上到下元素的非金属性逐渐减弱,单质的还原逐渐增强;
C.根据其最外层电子数结合同主族元素的元素周期律判断性;
D.根据同主族元素的元素周期律判断该元素的非金属性强弱,再判断其氧化物的水化物的酸性强弱.
解答 解:A.同主族元素单质磷是固体,根据元素周期律知同主族元素的单质的性质相似,所以砷是固体,故A正确;
B.同主族元素从上到下元素的非金属性逐渐减弱,单质的还原逐渐增强,磷比砷的非金属性强,则砷的还原性比磷强,故B错误;
C.N元素有-3、0、+2、+3、+5等多种化合价,根据同主族元素的相似性判断,砷可以存在-3、+3、+5等多种化合价,故C正确;
D.同主族元素从上到下元素的非金属性逐渐减弱,则磷比砷的非金属性强,As2O5对应水化物的酸性比H3PO4弱,故D正确;
故选B.
点评 本题考查了元素周期律的应用,侧重考查学生对元素周期律的掌握,明确相似性与递变性即可解答,题目难度不大.

练习册系列答案
相关题目
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 能使KSCN试液变红的溶液中:H+、Zn2+、SO32-、SO42- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 显强碱性的溶液中:K+、Na+、AlO2-、CO32- |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 遇Fe(CN)63-生成特征蓝色沉淀的溶液:Ca2+、Clˉ、ClOˉ、Fe3+ | |
| B. | 遇石蕊变红的溶液:Na+、NH4+、NO3ˉ、K+ | |
| C. | 通有足量NO2的溶液:K+、Na+、SO32ˉ、AlO2ˉ | |
| D. | 与铝反应产生大量氢气的溶液:Ba2+、HCO3ˉ、Iˉ、Fe2+ |
5.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( )

| A. | 可以用有机溶剂萃取 | |
| B. | 可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
15.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):
请计算H2(g)+Cl2(g)═2HCl(g)的反应热( )
| 化学键 | H-H | Cl-Cl | Cl-H |
| 键能/(kJ•mol-1) | 436 | 243 | 431 |
| A. | 862 kJ•mol-1 | B. | 679 kJ•mol-1 | C. | 183 kJ•mol-1 | D. | -183 kJ•mol-1 |
2.为完成相应实验,实验器材(规格和数量不限)足够的一项是( )
| 相应实验 | 实验器材(省略夹持装置) | |
| A | 氯化钠溶液的浓缩结晶 | 烧杯、玻璃棒、酒精灯 |
| B | 用盐酸除去硫酸钡中的少量碳酸铜 | 烧杯、漏斗、胶头滴管、滤纸 |
| C | 用浓硫酸配制0.5mol•L-1的溶液 | 烧杯、玻璃棒、胶头滴管、容量瓶 |
| D | 用溴水和CCl4除去NaBr溶液中的少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| A. | A | B. | B | C. | C | D. | D |
19.下列物质属于芳香烃,但不是苯的同系物的有( )
①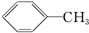 ②
② ③
③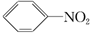 ④
④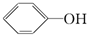 ⑤
⑤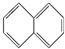 ⑥
⑥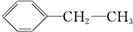
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥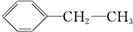
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
20.对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是( )
| A. | SO42- OH- Cl- K+ | B. | Na+ NO3- OH- Cl- | ||
| C. | K+ Na+ NO3- Cl- | D. | K+ CO32+ H+ Ba2+ |
 在有机物A分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.
在有机物A分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.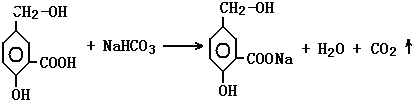 ;
; ;
;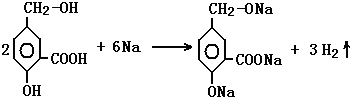 ;
; .
.