题目内容
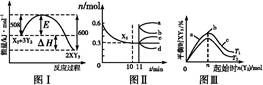
某工业反应为:X2(g)+3Y2(g) 2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
下列说法正确的是( )
 2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
下列说法正确的是( )
| A.由图Ⅰ可知,加入适当的催化剂,E和ΔH都减小 |
| B.图Ⅱ中0~10 min内该反应的平均速率v(Y2)="0.045" mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(X2)的变化曲线为d |
| C.图Ⅲ中a、b、c三点所处的平衡状态中,反应物X2的转化率最高的是b点 |
| D.图Ⅲ中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1<T2,K1<K2 |
B
催化剂能减小E,但不能改变ΔH大小,ΔH只取决于反应物和生成物的能量状态,A错;v(Y2)=3v(X2)=3×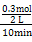 ="3×0.015" mol·L-1·min-1="0.045" mol·L-1·min-1,当压缩容器体积后,平衡右移,n(X2)减少,B对;n(Y2)的量越大,X2的转化率越高,所以c点X2转化率最高,C错;由图Ⅰ知该反应的ΔH<0,则其他条件相同时,温度越低,平衡向右进行的程度越大,平衡时XY3的百分含量越大,平衡常数K越大,即T1<T2,K1>K2,D错。
="3×0.015" mol·L-1·min-1="0.045" mol·L-1·min-1,当压缩容器体积后,平衡右移,n(X2)减少,B对;n(Y2)的量越大,X2的转化率越高,所以c点X2转化率最高,C错;由图Ⅰ知该反应的ΔH<0,则其他条件相同时,温度越低,平衡向右进行的程度越大,平衡时XY3的百分含量越大,平衡常数K越大,即T1<T2,K1>K2,D错。
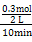 ="3×0.015" mol·L-1·min-1="0.045" mol·L-1·min-1,当压缩容器体积后,平衡右移,n(X2)减少,B对;n(Y2)的量越大,X2的转化率越高,所以c点X2转化率最高,C错;由图Ⅰ知该反应的ΔH<0,则其他条件相同时,温度越低,平衡向右进行的程度越大,平衡时XY3的百分含量越大,平衡常数K越大,即T1<T2,K1>K2,D错。
="3×0.015" mol·L-1·min-1="0.045" mol·L-1·min-1,当压缩容器体积后,平衡右移,n(X2)减少,B对;n(Y2)的量越大,X2的转化率越高,所以c点X2转化率最高,C错;由图Ⅰ知该反应的ΔH<0,则其他条件相同时,温度越低,平衡向右进行的程度越大,平衡时XY3的百分含量越大,平衡常数K越大,即T1<T2,K1>K2,D错。
练习册系列答案
相关题目

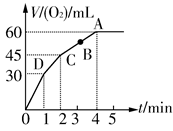
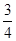 所需的时间约为__________________
所需的时间约为__________________ 2NH3(g)
2NH3(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。 2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( ) ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )