题目内容
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(1)②④ (2)①27.78 ②0.05 ③0.15
④正反应
④正反应
(1)①所述反应达到平衡状态;②生成2 mol NH3的同时生成2 mol H2,正反应速率大于逆反应速率,反应向正反应方向进行;③未指明化学反应速率的方向,无法判断;④混合气体的平均摩尔质量增大,说明气体的物质的量减小,反应向正反应方向进行;⑤因为容积固定,所以密度始终不变。
(2)①2 h时消耗N2的物质的量为1.50 mol-1.20 mol=0.30 mol,由热化学方程式,可知该反应放出的热量为92.60 kJ·mol-1×0.30 mol=27.78 kJ。
②v(N2)=v(NH3)/2=0.20 mol÷(2 L×1 h)÷2=0.05 mol·L-1·h-1。
③由表中数据可知,第3、4 h时反应已达到平衡状态,故N2、H2、NH3的平衡浓度为0.50 mol·L-1、1.50 mol·L-1、0.50 mol·L-1。故平衡常数K=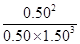 ≈0.15。
≈0.15。
④反应物和生成物各加入1.00 mol后,N2、H2、NH3的浓度为1.00 mol·L-1、2.00 mol·
L-1、1.00 mol·L-1,此时的Qc=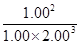 =0.125<K,故平衡向正反应方向移动。
=0.125<K,故平衡向正反应方向移动。
(2)①2 h时消耗N2的物质的量为1.50 mol-1.20 mol=0.30 mol,由热化学方程式,可知该反应放出的热量为92.60 kJ·mol-1×0.30 mol=27.78 kJ。
②v(N2)=v(NH3)/2=0.20 mol÷(2 L×1 h)÷2=0.05 mol·L-1·h-1。
③由表中数据可知,第3、4 h时反应已达到平衡状态,故N2、H2、NH3的平衡浓度为0.50 mol·L-1、1.50 mol·L-1、0.50 mol·L-1。故平衡常数K=
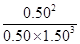 ≈0.15。
≈0.15。④反应物和生成物各加入1.00 mol后,N2、H2、NH3的浓度为1.00 mol·L-1、2.00 mol·
L-1、1.00 mol·L-1,此时的Qc=
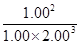 =0.125<K,故平衡向正反应方向移动。
=0.125<K,故平衡向正反应方向移动。
练习册系列答案
相关题目
 2C(g),在10s内反应物A的浓度由1mol/L降到0.4mol/L,则ν(C)为
2C(g),在10s内反应物A的浓度由1mol/L降到0.4mol/L,则ν(C)为 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( )
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( ) 2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。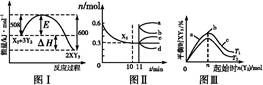
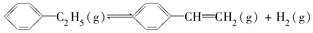 ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表: (W)=3
(W)=3