题目内容
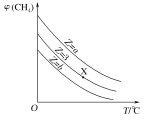
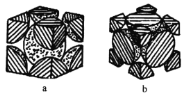
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的羟胺溶液, 羟胺的电离方程式为:NH2OH+H2O ![]() NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
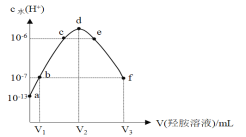
A.0.1 mol·L-1羟胺溶液的 pH=8.5B.b点溶液中:c(H+) =c(OH-)
C.d点对应溶液中存在:c(H+)=c (OH-)+c (NH2OH)D.该稀盐酸的浓度为0.2 mol·L-1
【答案】C
【解析】
分析题中由水电离的氢离子浓度变化曲线图可知,a~d段水电离出的氢离子浓度逐渐增大,在d~f段水电离出的氢离子浓度逐渐减小,在d点水的电离程度最大,此时溶液中的溶质为:NH3OHCl。据此进行判断。
A.根据弱电解质的电离常数Kb=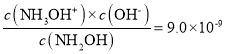 ,可得
,可得![]() ,则
,则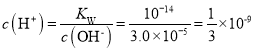 ,
,![]() ,故0.1 mol·L-1羟胺溶液的 pH=9.5,A项错误;
,故0.1 mol·L-1羟胺溶液的 pH=9.5,A项错误;
B.由分析可知,在b点时,盐酸过量,溶液溶质为HCl和 NH3OHCl,根据电荷守恒有:![]() ,因为
,因为![]() ,故溶液中
,故溶液中![]() ,B项错误;
,B项错误;
C.由图可知,d点时水电离出的c(H+)最大,说明此时溶液中的溶质为NH3OHCl,根据盐类水解的质子守恒可知:c(H+)=c (OH-)+c (NH2OH),C项正确;
D.由图可知,当未滴加羟胺溶液时,此时溶液为盐酸溶液,由水电离出的![]() ,则由水电离的
,则由水电离的![]() ,可以得出此时溶液的
,可以得出此时溶液的![]() mol/L,故该稀盐酸的浓度为0.1 mol·L-1,D项错误;
mol/L,故该稀盐酸的浓度为0.1 mol·L-1,D项错误;
答案选C。

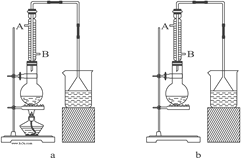
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
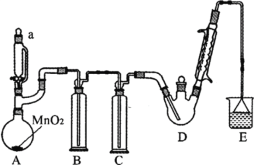
①制备反应原理:C2H5OH + 4Cl2 → CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl → C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器a中盛放的试剂是_____ ;装置B的作用是__________ 。
(2)若撤去装置C,可能导致装置D中副产物________ (填化学式)的量增加;装置D可采用_________ 加热的方法以控制反应温度在70℃左右。
(3)装置E中可能发生的无机反应的离子方程式有____________________ 。
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mol·L-1 Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。
滴定的反应原理:CCl3CHO +OH- → CHCl3 + HCOO-、 HCOO-+ I2 =H+ + 2I- + CO2↑ I2 + 2S2O32- = 2I-+ S4O62-
(6)请设计实验证明三氯乙酸的酸性比乙酸强。 __________________