题目内容
【题目】铜元素是一种金属化学元素,也是人体所必须的一种微量元素, 铜也是人类最早发现的金属,是人类广泛使用的一种金属,属于重金属。
(1)写出基态铜原子的价层电子排布式_________________。
(2)简单金属离子在水溶液中的颜色大多与价层电子中含有的未成对电子数有关,如Fe3+呈黄色,Fe2+呈绿色,Cu2+呈蓝色等。预测Cu+为_____色,解释原因________________。
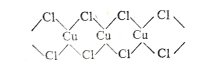
(3)X射线研究证明,CuCl2的结构为链状,如图所示,它含有的化学键类型为_________,在它的水溶液中加入过量氨水,得到 [Cu(NH3)4]Cl2溶液, [Cu(NH3)4]Cl2中H-N-H的夹角_________(填“大于”、“等于”或“小于”)NH3分子中的H-N-H的夹角,原因是___________。
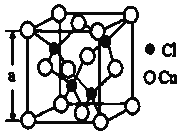
(4)某种铜的氯化物晶体结构如图:此晶体中铜原子的配位数是__________,若氯原子位于铜形成的四面体的体心,且铜原子与铜原子、铜原子与氯原子都是采取最密堆积方式,则氯原子与铜原子半径之比为__________________。
【答案】3d104s1 无 Cu+中无单电子 共价键、配位键 大于 [Cu(NH3)4]Cl2 中氮原子无孤电子对,NH3 中氮原子有孤电子对,孤电子对对成键电子排斥力大,键角小 4 ![]()
【解析】
(1)铜是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,价层电子排布式3d104s1,故答案为:3d104s1;
(2) 根据价层电子排布,Fe3+有5对未成对电子,呈黄色;Fe2+有4对未成对电子,呈绿色,可知Cu+无颜色,因为Cu+中无单电子,故答案为:无;Cu+中无单电子;
(3)根据氯化铜的结构可知分子中含有的化学键类型为共价键、配位键;NH3中N原子含有3个共价键和1个孤电子对,由于NH3提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小,故答案为:共价键、配位键;大于; [Cu(NH3)4]Cl2 中氮原子无孤电子对,NH3 中氮原子有孤电子对,孤电子对对成键电子排斥力大,键角小;
(4)晶胞中Cl原子数目为4,晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4;若C1原子位于Cu原子构成的四面体体心,则体对角线是铜原子和氯原子的半径之和的4倍,Cu原子位于立方体的顶点和面心,为面心立方最密堆积,则面对角线是铜原子半径的4倍,设晶胞的边长为a cm,面对角线等于
=4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4;若C1原子位于Cu原子构成的四面体体心,则体对角线是铜原子和氯原子的半径之和的4倍,Cu原子位于立方体的顶点和面心,为面心立方最密堆积,则面对角线是铜原子半径的4倍,设晶胞的边长为a cm,面对角线等于![]() ,则铜原子半径为
,则铜原子半径为![]() ,体对角线等于
,体对角线等于![]() ,则氯原子半径为
,则氯原子半径为![]() ,则氯原子与铜原子半径之比等于
,则氯原子与铜原子半径之比等于![]() ,故答案为:4;
,故答案为:4;![]() 。
。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案