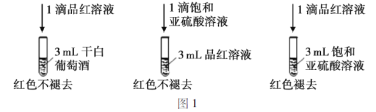
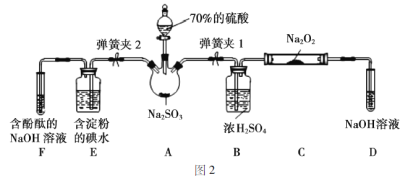
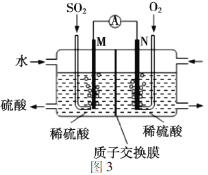
题目内容
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
【答案】(1)0.75 mol·L-1 (2)0.05mol/(L·min) (3)x=2
【解析】
考查可逆反应的有关计算,一般采用三段式。
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) n n 0 0
转化量(mol) 1.5 0.5 0.5x 1.0
5min后(mol) n-1.5 n-0.5 0.5x 1.0
(1)所以(n-1.5)(n-0.5)=3∶5
解得n=3
此时A的浓度是1.5mol÷2L=0.75 mol·L-1
(2)因为反应速率之比是相应的化学计量数之比
所以B的平均反应速率0.1mol/(L·min)÷2=0.05mol/(L·min)
(3)C的平均反应速率是0.1mol/(L·min)
所以0.1mol/(L·min)×2L×5min=0.5x
解得x=2

练习册系列答案
相关题目
【题目】结合元素周期律,结合下列事实推测不合理的是()
事实 | 推测 | |
A | IVA族 | 同族 |
B | HI在230℃时分解,HCl在1500℃时分解 | HF分解温度大于1500℃ |
C | H3PO4是中强酸,H2SO4是强酸 | HClO4是强酸 |
D | Na、Al通常用电解法冶炼 | Mg可用电解法冶炼 |
A.AB.BC.CD.D