题目内容
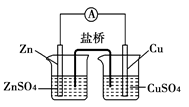
A、B、C三个烧杯中分别盛有物质的量浓度相同的足量稀硫酸。
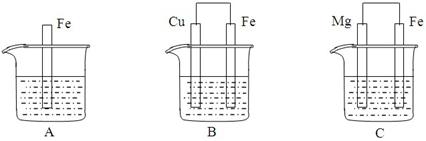
⑴A中反应的离子方程式为____________________________________________________
⑵B中Fe电极所发生反应的电极反应式为______________________________________,
Cu电极附近溶液的pH_____________(填“增大”、“减小”或“不变”)
⑶C中若正极产生112mL气体(标准状况),则负极金属质量减少_____________g。
⑷比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________________________(填字母)。

⑴A中反应的离子方程式为____________________________________________________
⑵B中Fe电极所发生反应的电极反应式为______________________________________,
Cu电极附近溶液的pH_____________(填“增大”、“减小”或“不变”)
⑶C中若正极产生112mL气体(标准状况),则负极金属质量减少_____________g。
⑷比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________________________(填字母)。
(1)Fe+2H+=Fe2++H2↑ (2分)
(2)Fe-2e-=Fe2+(1分) 增大 (1分)0.12g (2分) (3)B A C (2分)
(2)Fe-2e-=Fe2+(1分) 增大 (1分)0.12g (2分) (3)B A C (2分)
试题分析:(1)根据装置图可知,A是铁和稀硫酸的化学反应,离子方程式是Fe+2H+=Fe2++H2↑。
(2)B中构成原电池,铁的金属性强于铜,铁是负极,失去电子,电极反应式是Fe-2e-=Fe2+。铜是正极,溶液中的氢离子在正极得到电子析出氢气,所以Cu电极附近溶液的pH增大。
(3)C中也是原电池,其中镁的金属性强于铁的,镁是负极失去电子,电极反应式是Mg-2e-=Mg2+。正极是铁,溶液中的氢离子得到电子,电极反应式是2H++2e-=H2↑。氢气的物质的量是0.112L÷22.4L/mol=0.005mol,则负极镁失去电子的物质的量是0.005mol×2,所以消耗镁的物质的量是0.005mol,质量是0.005mol×24g/mol=0.12g。
(4)根据以上分析可知,C中铁被保护,则A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C。
点评:该题的关键是明确原电池的工作原理以及组成特点,然后结合题意和装置图灵活运用即可。在进行有关计算时利用好电子的得失守恒,有利于培养学生的逻辑推理能力 和规范的答题能力。

练习册系列答案
相关题目