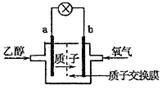
题目内容
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是( )
①溶液中硫酸的物质的量浓度保持不变
②Cu极上有气泡产生,发生还原反应
③Cu为负极,Zn为正极
④原电池在工作时电子由负极通过溶液流向正极
⑤该装置将化学能转变为电能
①溶液中硫酸的物质的量浓度保持不变
②Cu极上有气泡产生,发生还原反应
③Cu为负极,Zn为正极
④原电池在工作时电子由负极通过溶液流向正极
⑤该装置将化学能转变为电能
| A.②⑤ | B.③⑤ | C.①② | D.④⑤ |
A
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,据此可知,锌是负极,失去电子;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应,生成氢气,所以选项②⑤正确,答案选A。
点评:该题是高考中的常见题型与重要的考点,属于中等难度试题的考查,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用。

练习册系列答案
相关题目
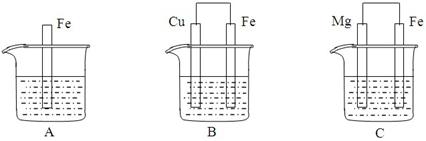



 Li2FeSiO4 +Li2SO4 +SiO2
Li2FeSiO4 +Li2SO4 +SiO2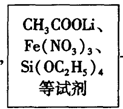
 Li2FeSiO4
Li2FeSiO4 Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ; 2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是 ( )
2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是 ( )