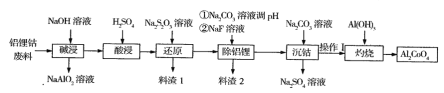
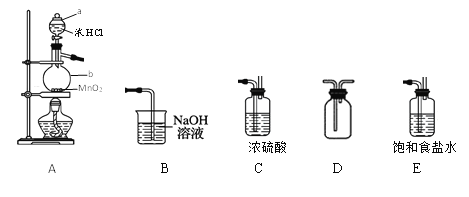
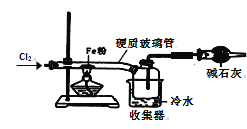
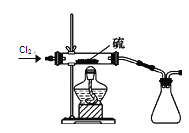
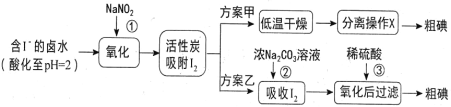
题目内容
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:

则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
【答案】[Ar]3d24s2 激发 Li<B<Be Si2H4、Si3H6 SiH4 原子半径Si>C,Si-Si长度大于C-C,键能较小,键的稳定性较差,不利于形成长链 随着相对分子质量的增大而升高 12 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)钛是22号元素。从左到右,第一电离能增大;
(2)硅原子最外层有4个电子,乙硅烯、丙硅烯分子中,均有硅原子形成了3个σ键;
(3)观察晶胞图知,顶点A紧邻等距离最近的X位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离A最近的X均有4个,故共有3×4=12个。
(1)钛是22号元素,电子排布式为[Ar]3d24s2。基态钙原子的20个电子分占6个不同的能级,即电子有6种能量状态,现在有7种能量状态,说明它处于激发态。从左到右,第一电离能增大,Be (2s2) s能级全充满是稳定状态,故由小到大的前三种元素是Li<B<Be。
(2)硅原子最外层有4个电子,乙硅烯、丙硅烯分子中,均有硅原子形成了3个σ键,故二者分子中均有硅原子为sp2 杂化。甲硅烷分子中硅为sp3杂化,是正四面体结构。原子半径Si>C,Si-Si长度大于C-C,键能较小,键的稳定性较差,不利于形成长链。硅烷同系物组成、结构相似,随着分子中硅原子数目的增加,熔、沸点升高。
(3)观察晶胞图知,顶点A紧邻等距离最近的X位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离A最近的X均有4个,故共有3×4=12个。M位于体心,故其坐标为(![]() ,
,![]() ,
,![]() )。根据均摊原理知,X是氧,一个晶胞中含有一个“CaTiO3”,晶胞的体积是1×10-30r3cm3,由此可求出其密度为
)。根据均摊原理知,X是氧,一个晶胞中含有一个“CaTiO3”,晶胞的体积是1×10-30r3cm3,由此可求出其密度为![]() g/cm3。
g/cm3。

【题目】空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液。将SO2和NO2按一定比例混合,以N2或空气为载气通入反应室,相同时间后,检测吸收液中SO42-的含量数据如下表所示,下列说法正确的是
反应室 | 载气 | 吸收液 | SO42-含量 | 数据分析 |
① | N2 | 蒸馏水 | a | b |
② | 3%氨水 | b | ||
③ | 空气 | 蒸馏水 | c | |
④ | 3%氨水 | d |
A.实验表明:酸性环境下,更有利于硫酸盐的形成
B.本研究表明:硫酸盐的形成主要与N2有关
C.反应室①中可能发生反应:SO2+2NO2+2H2O=H2SO4+2HNO2
D.燃煤产生的气体盲目排放会引起酸雨但不会加剧雾霾形成