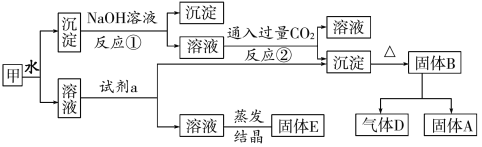
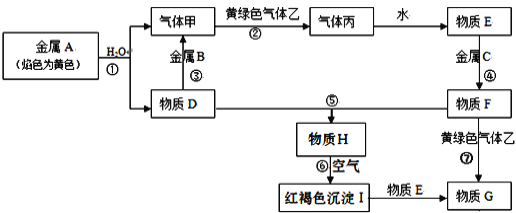
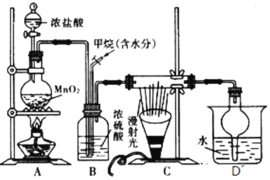
题目内容
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
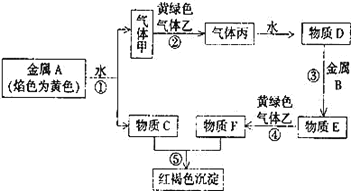
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
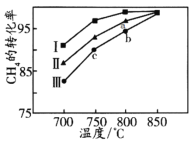
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态_________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是_________________________________________。
(2)在一刚性密闭容器中,加入Ni/α-Al2O3催化剂并加热至1123K,使CH4和CO2发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),初始时CH4和CO2的分压分别为20kPa、25kPa,研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
【答案】cd 不是 b和c都未达平衡,b点温度高,反应速率快,相同时间内转化率高 15 1.95
【解析】
(1)①a.过程Ⅱ中,CO、CO2都转化为CO,H2转化为H2O;实现了含碳物质与含氢物质的分离;
b.从起始反应物和产物分析可得,CO2与H2反应生成H2O(g)和CO;
c.从反应过程看,CO先转化为CaCO3,后CaCO3再转化为CO;
d.Fe3O4、CaO起初参加反应,后来又生成,所以为催化剂,催化剂不改变反应物和生成物的总能量。
②催化剂不能改变反应物的平衡转化率,但可改变平衡前的转化率,通过不同催化剂作用下的转化率比较,可判断a、b、c三点的CH4的转化率都小于同温度下的最高转化率,由此可确定反应仍正向进行。
(2)利用阿伏加德罗定律的推论,气体的压强之比等于物质的量之比,所以利用某时刻某物质的压强,可计算出该时刻另一物质的压强,由此可计算出反应速率。
(1)①a.过程Ⅱ中,CO、CO2都转化为CO,H2转化为H2O;实现了含碳物质与含氢物质的分离,a正确;
b.从起始反应物和产物分析可得,CO2与H2反应生成H2O(g)和CO,b正确;
c.从反应过程看,CO先转化为CaCO3,后CaCO3再转化为CO,c不正确;
d.Fe3O4、CaO起初参加反应,后来又生成,所以为催化剂,催化剂不改变反应物和生成物的总能量,所以不能降低反应的ΔH,d不正确;
故选cd。答案为:cd;
②相同温度下,尽管所使用的催化剂不同,但达平衡时CH4的转化率应相同,从图中可以看出,a点CH4的转化率比同温度下的催化剂Ⅰ作用下的转化率低,则表明a点所代表的状态不是平衡状态;从图中可以看出,虽然b点CH4的转化率高,但仍低于同温度下的最高转化率,说明反应仍未达到平衡,b点CH4的转化率高于c点,只能是反应速率快所致,故原因是b和c都未达平衡,b点温度高,反应速率快,相同时间内转化率高。答案为:不是;b和c都未达平衡,b点温度高,反应速率快,相同时间内转化率高;
(2)利用题给数据,我们可建立如下三段式:
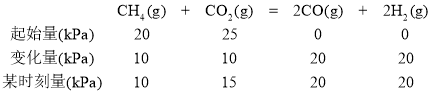
从而得出p(CO2)=15kPa,υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1=1.3×10-2×10×15 mol·g-1·s-1=1.95 mol·g-1·s-1。答案为:15;1.95。

 名校课堂系列答案
名校课堂系列答案