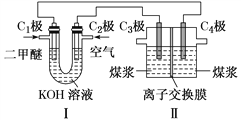
题目内容
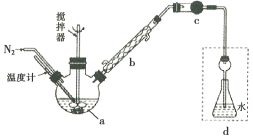
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:

回答下列问题:
(1)仪器a的名称是________,搅拌器的作用是_______。
(2)反应结束后,还要继续通入N2的目的是__________;仪器c盛装的试剂是________(填序号)。
A.碱石灰 B.浓硫酸 C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯:_____________
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_________(填序号)。

(5)将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为______;若消耗22.50mL AgNO3溶液,则无水FeCl3的转化率为_____。
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏_______(填“高”或“低”)。
【答案】 三颈烧瓶或三口烧瓶 加快反应速率 将反应生成的HCl全部排至装置d,被水完全吸收 CD 蒸馏滤液,收集132℃的馏分 eg 红色沉淀刚好出现 90% 低
【解析】分析:将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,然后用硝酸银滴定生成的氯化氢测定无水FeCl3的转化率;根据表格数据,C6H5Cl 和C6H4C12的沸点相差较大,从滤液中回收过量的氯苯,可以选择蒸馏的方法分离;分析误差时需要根据c(待测)=
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,然后用硝酸银滴定生成的氯化氢测定无水FeCl3的转化率;根据表格数据,C6H5Cl 和C6H4C12的沸点相差较大,从滤液中回收过量的氯苯,可以选择蒸馏的方法分离;分析误差时需要根据c(待测)=![]() 分析判断。
分析判断。
详解:(1)根据装置图,仪器a是三颈烧瓶,搅拌可以使反应物充分混合,加快反应速率,故答案为:三颈烧瓶;加快反应速率;
(2)反应结束后,继续通入N2,可以将反应生成的HCl全部排至装置d,被水完全吸收,减少实验误差;仪器c的目的是干燥生成的氯化氢,应该选择固态酸性或中性干燥剂,可以选择无水氯化钙或硅胶,故答案为:将反应生成的HCl全部排至装置d,被水完全吸收;CD;
(3)根据表格数据,C6H5Cl 和C6H4C12的沸点相差较大,从滤液中回收过量的氯苯,可以选择蒸馏的方法分离,只要收集132℃的馏分即可,故答案为:蒸馏滤液,收集132℃的馏分;
(4)氯化氢极易溶于水,需要防止倒吸,能代替图中虚线框内部分的有eg,f为密封装置,氯化氢气体不能通入,h会发生倒吸现象,故答案为:cg;
(5) 锥形瓶内的溶液为氯化氢的水溶液,将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,根据表格数据,首先生成氯化银出,后生成铬酸银沉淀,因此终点现象为红色沉淀刚好出现;根据方程式2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,HC1+ AgNO3=AgCl+ HNO3可知,2FeCl3~HC1↑~ AgNO3,n(FeCl3)=2n(AgNO3)=2×0. 2000mol·L-1×0.02250L×
2FeCl3+C6H4C12+HC1↑,HC1+ AgNO3=AgCl+ HNO3可知,2FeCl3~HC1↑~ AgNO3,n(FeCl3)=2n(AgNO3)=2×0. 2000mol·L-1×0.02250L×![]() =0.9mol,无水FeCl3的转化率为
=0.9mol,无水FeCl3的转化率为![]() ×100%=90%,故答案为:红色沉淀刚好出现;90%;
×100%=90%,故答案为:红色沉淀刚好出现;90%;
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会,导致溶液的体积偏小,根据c(待测)=![]() ,测定结果偏低,故答案为:低。
,测定结果偏低,故答案为:低。

【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 用铂丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 nol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D