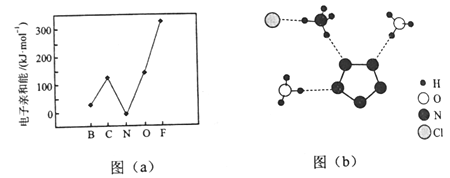
��Ŀ����
����Ŀ�������£���0.1 mol/L�İ�ˮ�ζ�10.00 mL 0.1 mol/L����HA�����Ӱ�ˮ�����(V)����Һ��lg![]() �Ĺ�ϵ��ͼ��ʾ������˵���������
�Ĺ�ϵ��ͼ��ʾ������˵���������

A. X�㣺c(A-)>c(H+)>c(NH4+)>c(OH-) B. Y�㣺V(NH3��H2O) <10.00 mL
C. Z�㣺2c(A-)= c(NH4+)+c(NH3��H2O) D. HA�ĵ��뷽��ʽΪHA=H++A-
���𰸡�B
����������ͼ��֪��0.1 mol/L����HA��lg![]() =12����
=12����![]() =1012��
=1012��![]() =1012��c2(H+)=1012KW=1012
=1012��c2(H+)=1012KW=1012![]() 10-14=10-2��c(H+)=0.1mol/L��˵��HA��ȫ���룬Ϊǿ�ᡣA. X�㣺����5mL0.1 mol/L�İ�ˮ�õ���Ũ�ȵ�NH4A��HA�����Һ��c(A-)>c(H+)>c(NH4+)>c(OH-)��A��ȷ��B. Y�㣺lg
10-14=10-2��c(H+)=0.1mol/L��˵��HA��ȫ���룬Ϊǿ�ᡣA. X�㣺����5mL0.1 mol/L�İ�ˮ�õ���Ũ�ȵ�NH4A��HA�����Һ��c(A-)>c(H+)>c(NH4+)>c(OH-)��A��ȷ��B. Y�㣺lg![]() =0����
=0����![]() =1��c(H+)=c(OH-),��Һ�����ԣ������백ˮV(NH3��H2O) =10.00 mL��ǡ�õõ�NH4A��Һ����ʱ��Һ����NH4+ˮ��������ԣ��ʼ���İ�ˮӦ��10.00 mL��B����C. Z��Ϊ��Ũ�ȵ�NH4A��NH3��H2O�Ļ����Һ�����������غ㣬2c(A-)= c(NH4+)+c(NH3��H2O)��C��ȷ��D. HAΪǿ�ᣬ���뷽��ʽΪHA=H++A-��D��ȷ��������ȷ��ӦѡB��
=1��c(H+)=c(OH-),��Һ�����ԣ������백ˮV(NH3��H2O) =10.00 mL��ǡ�õõ�NH4A��Һ����ʱ��Һ����NH4+ˮ��������ԣ��ʼ���İ�ˮӦ��10.00 mL��B����C. Z��Ϊ��Ũ�ȵ�NH4A��NH3��H2O�Ļ����Һ�����������غ㣬2c(A-)= c(NH4+)+c(NH3��H2O)��C��ȷ��D. HAΪǿ�ᣬ���뷽��ʽΪHA=H++A-��D��ȷ��������ȷ��ӦѡB��

��ϰ��ϵ�д�
 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
�����Ŀ