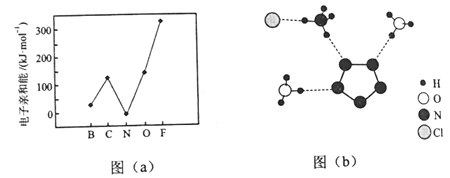
题目内容
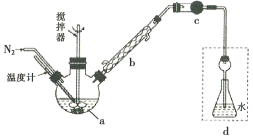
【题目】向25℃时,体积均为20mL、浓度均为0. 1mol·L-1的两种酸HX、HY溶液中分別滴加0. 1mol·L-1的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
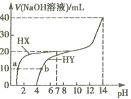
A. HX与NaOH溶液反应的离子方程式为:HX +OH-=X-+H2O
B. Ka(HY)的数量级约为10-10
C. b点时: c(Na+)=c(Y-)+c(HY)
D. V(NaOH)= 20mL时,两种反应后的溶液中c(X-)>c(Y-)
【答案】D
【解析】分析:浓度均为0.1molL-1的两种酸HX、HY,由图可知,HX的pH等于1,HY的pH等于4,则HX为强酸,HY为弱酸,然后根据盐类水解的规律结合溶液的pH分析解答。
详解:A.由图可知,HX为强酸,所以HX与NaOH溶液发生反应的离子方程式为H++OH-=H2O,故A错误;B.浓度为0.1molL-1的HY,由图可知,HY的pH等于4,则Ka(HY)=![]() =
=![]() =10-7,故B错误;C. b点溶液中存在等浓度的HY和NaY,根据物料守恒,2c(Na+)=c(Y-)+c(HY),故C错误;D. V(NaOH)= 20mL时,两个反应均恰好完全进行,生成盐溶液,由于Y-发生水解,因此反应后的溶液中c(X-)>c(Y-),故D正确;故选D。
=10-7,故B错误;C. b点溶液中存在等浓度的HY和NaY,根据物料守恒,2c(Na+)=c(Y-)+c(HY),故C错误;D. V(NaOH)= 20mL时,两个反应均恰好完全进行,生成盐溶液,由于Y-发生水解,因此反应后的溶液中c(X-)>c(Y-),故D正确;故选D。

 作业辅导系列答案
作业辅导系列答案【题目】沉淀溶解平衡在生产、科研和环保等领域有着许多应用。
(1)除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入Cu(OH)2,调节溶液的PH,铁离子就会全部转化为Fe(OH)3沉淀除去。
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小等于1×10-5molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL-1,通过计算确定应调节溶液的pH范围是______。(已知lg5=0.7)
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol·L-1 AgNO3溶液 | 现象a,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变为红色的离子方程式:____________________。
②步骤3中现象a是____________________________。
③用化学平衡原理解释步骤4中的实验现象:_________________________________。