题目内容
【题目】氢气是一种常用的化工原料,如合成氨和尿素[CO(NH2)2]等。
(1)以H2合成CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4 kJ·mol-1
②NH3(g)+![]() CO2(g)===
CO2(g)===![]() NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________。
(2)电解制H2的原理为C(s)+2H2O(l)![]() CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
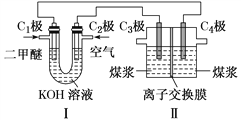
①分别写出电极C1和C3的电极反应式__________________;___________________。
②离子交换膜可能是________(填字母)。
a.阳离子交换膜 b.阴离子交换膜 c.质子交换膜
③已知4.6 g二甲醚参与反应,假设装置Ⅰ的能量转化率为100%,C4极收集到11.2L(标准状况)气体,装置Ⅱ的电流效率η=________。![]()
【答案】 N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-179.3 kJ·mol-1 CH3OCH3+16OH--12e-==2CO![]() +11H2O C-4e-+2H2O===CO2↑+4H+ ac 83.3%
+11H2O C-4e-+2H2O===CO2↑+4H+ ac 83.3%
【解析】(1)已知:①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4 kJ·mol-1
②NH3(g)+![]() CO2(g)===
CO2(g)===![]() NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5 kJ·mol-1
根据盖斯定律,由①+②×2+③得反应N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=ΔH1+ΔH2×2+ΔH3=-92.4 kJ·mol-1-79.7 kJ·mol-1×2+72.5 kJ·mol-1=-179.3 kJ·mol-1;(2)①燃料电池中二甲醚(CH3OCH3)的一极为电池的负极,二甲醚在碱性条件下失电子产生碳酸根离子,故电极C1的电极反应式为CH3OCH3+16OH--12e-==2CO![]() +11H2O;C2为电池的正极,连接正极的C3为电解池的阳极,根据电解制H2的原理C(s)+2H2O(l)
+11H2O;C2为电池的正极,连接正极的C3为电解池的阳极,根据电解制H2的原理C(s)+2H2O(l)![]() CO2(g)+2H2(g)可知,C3电极电解煤浆液(由煤粉与稀硫酸组成)碳失电子产生二氧化碳,电极反应式为C-4e-+2H2O===CO2↑+4H+;②离子交换膜是允许氢离子通过,保证产生的氢气和二氧化碳分开,故可能是阳离子交换膜或质子交换膜,答案选ac;③装置Ⅰ中负极反应式为CH3OCH3+16OH--12e-==2CO
CO2(g)+2H2(g)可知,C3电极电解煤浆液(由煤粉与稀硫酸组成)碳失电子产生二氧化碳,电极反应式为C-4e-+2H2O===CO2↑+4H+;②离子交换膜是允许氢离子通过,保证产生的氢气和二氧化碳分开,故可能是阳离子交换膜或质子交换膜,答案选ac;③装置Ⅰ中负极反应式为CH3OCH3+16OH--12e-==2CO![]() +11H2O,n(CH3OCH3)=
+11H2O,n(CH3OCH3)= ![]() ,装置Ⅰ向装置Ⅱ提供的电子的物质的量为
,装置Ⅰ向装置Ⅱ提供的电子的物质的量为![]() ;n(H2)=
;n(H2)= ![]() ,生成0.5mol氢气需要电子的物质的量为1mol,根据电流效率定义,装置Ⅱ的电流效率η=
,生成0.5mol氢气需要电子的物质的量为1mol,根据电流效率定义,装置Ⅱ的电流效率η=![]() 。
。