题目内容
4.已知某酸H2B在水溶液中存在下列关系::①H2B?H++HB-,②HB-?H++B2-.则下列关于酸式盐NaHB的溶液的说法中一定正确的是( )
| A. | NaHB的电离方程式为:NaHB?Na-+H-+B2- | |
| B. | NaHB溶液一定呈酸性 | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H20 | |
| D. | NaHB溶液中一定存在:c(Na+)+c(H+)═c(HB-)+2c(B2-)+c(OH-) |
分析 据H2B在水溶液中的电离方程式可知,H2B为二元弱酸,
A、H2B为弱电解质,HB-不能拆开;
B、不知道HB-的电离程度与水解程度大小,无法判断溶液酸碱性;
C、H2B为弱电解质,HB-不能拆开;
D、据电荷守恒分析.
解答 解:A、H2B为二元弱酸,NaHB的电离方程式为:NaHB?Na-+HB-,HB-?H-+B2-,故A错误;
B、HB-的电离程度大于水解程度时,溶液显酸性,HB-的电离程度小于水解程度时,溶液显碱性,故B错误;
C、NaHB和NaOH溶液反应的离子方程式为HB-+OH-═H20+B2-,故C错误;
D、在NaHB溶液中存在电荷守恒:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),故D正确;
故选D.
点评 本题考查了溶液中的电荷守恒、弱电解质的电离,题目难度中等,注意掌握强弱电解质的概念及判断方法,能够根据电荷守恒、物料守恒、盐的水解原理分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
| A. | 钡与水反应不如钠与水反应剧烈 | B. | 钡可以从KCl溶液中置换出钾 | ||
| C. | Ba(OH)2可与NH4Cl反应,反应放热 | D. | 碱性:KOH>Ba(OH)2>NaOH |
15.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 含有1molFe(OH)3的氢氧化铁胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 1mol-L-1Na2CO3溶液100mL,含有0.1NA个CO32- | |
| C. | 足量的铁与1molCl2充分反映转移的电子数为3NA | |
| D. | 高温常压下,22.4L的一氯甲烷中含有的分子数小于NA个 |
12.最近《美国科学院院刊》发表了关于人体体香的研究文章称:人的体味中存在两种名为“AND”和“EST”的荷尔蒙,它们的结构简式如图.结合以上信息,下列说法正确的是( )
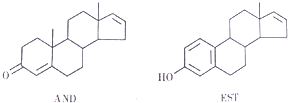

| A. | 这两种分子均能与NaOH溶液反应 | |
| B. | AND和KST分别与足量氢气加成后的两种产物互为同系 | |
| C. | AMD和EST均瓸于芳香族化合物 | |
| D. | EST的M分丼构体中,有的结构中含有葱环(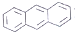 ) ) |
19.下列物质中不能用来区分乙酸、乙醇、苯的是( )
| A. | 溴水 | B. | 碳酸钠溶液 | C. | 紫色石蕊试液 | D. | 金属钠 |
6.设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |
3.下列反应中,离子方程式书写正确的是( )
| A. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氢氧化钡与盐酸反应:OH-+H+=H2O |
4.常温下,下列有关叙述正确的是( )
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
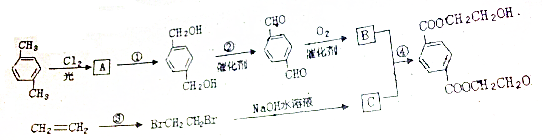
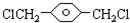 ,
,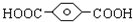 ,HOCH2CH2OH.
,HOCH2CH2OH.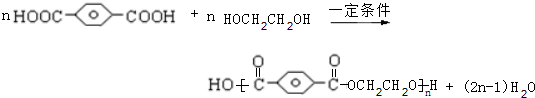 .
.