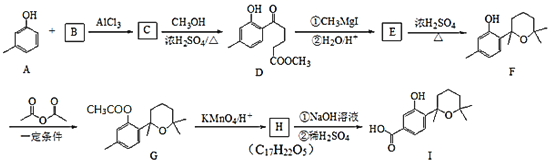
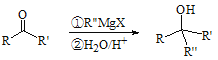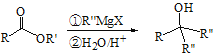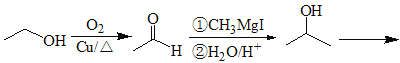题目内容
【题目】Ⅰ.可逆反应3A(g)![]() 3B(?)+C(?) △H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?) △H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量___;
②若B、C都不是气体,气体的平均相对分子质量___;
③若B是气体,C不是气体,气体的平均相对分子质量___;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是___态,C的状态是__态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是___。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是___。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K 和温度T的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K 和温度T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:[CO2]·[H2]=[CO]·[H2O],试判断此时的温度为__℃;
(5)830℃充入等体积的CO2 和H2 达到平衡后CO2 的转化率为___;
Ⅲ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下__(填“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下__(填“能”或“不能”)自发进行。
【答案】变小 不变 变小 气 液或固 BC ![]() 吸热 BC 830 50% 不能
吸热 BC 830 50% 不能
【解析】
Ⅰ.(1)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的50%,则说明平衡不移动,反应物气体的计量数等于生成物气体的计量数;
(3)能使混合气体平均相对分子质量减小,根据M=mn,反应前后质量守恒,n减小即可,应是平衡向正反应方向移动,结合温度、压强对平衡移动的影响解答该题;
Ⅱ. (1)K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)由表格中数据可知,温度越高K越大;
(3)结合平衡的特征“等、定”及衍生的物理量判定,平衡状态下正逆反应速率相同,各组分含量保持不变;
(4)根据达到平衡状态的标志和判断方法解题;
(5)根据三段式结合转化率的定义求解;
Ⅲ. (1)根据反应能否自发进行的判据:△H-T△S<0,反应自发进行,代入数据来计算。
Ⅰ. (1)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
①若B.C都是气体,气体的总质量不变,但物质的量增大,则气体的平均相对分子质量变小,故答案为:变小;
②若B.C都不是气体,气体只有A,则气体的平均相对分子质量不变,故答案为:不变;
③若B是气体,C不是气体,气体的物质的量不变,但气体的质量减小,则相对分子质量减小,故答案为:变小;
(2)如果平衡后保持温度不变,将容器体积增加一倍,如平衡不移动,则新平衡时A的浓度是原来的50%,符合题意,则说明平衡不移动,反应物气体的计量数等于生成物气体的计量数,所以B为气体,C为固体或液体,故答案为:气;固或液;
(3)根据M=![]() ,能使混合气体平均相对分子质量减小,反应前后质量守恒,只要n减小即可,应是平衡向正反应方向移动。
,能使混合气体平均相对分子质量减小,反应前后质量守恒,只要n减小即可,应是平衡向正反应方向移动。
A. 通入N2,不会引起化学平衡的移动,A项错误;
B. 通入NO2,压强增大,平衡正向移动,n减小,能使混合气体平均相对分子质量增大,B项正确;
C. 通入N2O4,压强增大,平衡正向移动,n减小,能使混合气体平均相对分子质量增大,C项正确;
D. 升高温度,平衡逆向移动,n增大,所以使混合气体平均相对分子质量减小,D项错误;
故答案为BC;
Ⅱ. (1)CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K=![]() ;
;
(2)由表格中数据可知,温度越高K越大,可知升高温度平衡正向移动,正反应为吸热反应,故答案为:吸热;
(3)A.该反应为气体体积不变的反应,容器中压强始终不变,不能判定平衡,A项错误;
B. 混合气体中c(CO)不变,符合平衡特征“定”,达到平衡状态,B项正确;
C.v正(H2)=v逆(H2O),符合平衡特征“等”,达到平衡状态,C项正确;
D.c(CO2)=c(CO),与起始量、转化率有关,不能判定平衡状态,D项错误;
故答案为:BC;
(4)某温度下,平衡浓度符合下式::[CO2]·[H2]=[CO]·[H2O],则根据K的表达式可知K=![]() =1,结合表中数据可知,温度为830℃,故答案为:830;
=1,结合表中数据可知,温度为830℃,故答案为:830;
(5)同条件下,气体的体积之比等于气体的物质的量之比,也等于密闭容器中气体的浓度之比,则830℃充入等体积的CO2 和H2,设起始量均为1,CO2转化量为x,则
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L) 1 1 0 0
转化量(mol/L) x x x x
平衡量(mol/L) 1-x 1-x x x
因此温度下K=1,则![]() =1,即x=0.5,,故达到平衡后CO2 的转化率为
=1,即x=0.5,,故达到平衡后CO2 的转化率为![]() =50%,故答案为:50%;
=50%,故答案为:50%;
Ⅲ. C(s)+H2O(g)![]() H2(g)+CO(g) 自由能复合判据ΔG=ΔH-TΔS,只有当ΔG小于0时反应才能自发进行,因ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,带入数据得△HT△S=131.3 kJ·mol-1T×133.7×0.001 kJ·mol-1·K-1,在低温下,该值一定是大于0的,所以不能在低温下自发进行,故答案为:不能。
H2(g)+CO(g) 自由能复合判据ΔG=ΔH-TΔS,只有当ΔG小于0时反应才能自发进行,因ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,带入数据得△HT△S=131.3 kJ·mol-1T×133.7×0.001 kJ·mol-1·K-1,在低温下,该值一定是大于0的,所以不能在低温下自发进行,故答案为:不能。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案