��Ŀ����
����Ŀ���ۺ���H (![]() )��һ�־�������ά���㷺���ڸ���ɲ��Ƭ����ϳ�·�����£�
)��һ�־�������ά���㷺���ڸ���ɲ��Ƭ����ϳ�·�����£�

��֪����C��D��G��Ϊ�����廯��������о�ֻ�����ֲ�ͬ��ѧ��������ԭ�ӡ�
��Diels��Alder��Ӧ��![]() ��
��
(1)����A�ķ�Ӧ������________��D��������______��F�����������ŵ�������______��
(2)B�Ľṹ��ʽ��______����B��C���ķ�Ӧ�У���C�⣬����һ�ֲ�����______��
(3)D+G��H�Ļ�ѧ����ʽ��___________________________________________��
(4)Q��D��ͬϵ���Է���������D��14����Q���ܵĽṹ��_____�֣����к˴Ź���������4��壬�ҷ������Ϊ1��2��2��3�Ľṹ��ʽΪ__________________________________(��дһ��)��
(5)��֪����Ȳ��1��3������ϩҲ�ܷ���Diels��Alder��Ӧ������1��3������ϩ����ȲΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�  ��д���ϳ�·��_______________________(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��
��д���ϳ�·��_______________________(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��
���𰸡���ȥ��Ӧ �Ա������� ��ԭ�ӡ����� ![]() H2O n
H2O n![]() +n
+n
![]()
![]() +(2n-1)H2O 10
+(2n-1)H2O 10  ��
��
![]()
![]()
![]()
![]()

![]()

��������
�Ҵ�������ȥ��Ӧ����AΪCH2��CH2��C����������D��D�к����Ȼ���C��D��G��Ϊ�����廯��������о�ֻ�����ֲ�ͬ��ѧ��������ԭ�ӣ�C����������Ӧ����D��D��Ӧ���������Ȼ�������H�ṹ��ʽ֪��DΪ![]() ��GΪ
��GΪ![]() ��������Ϣ��֪������B�ķ�ӦΪ�ӳɷ�Ӧ��BΪ
��������Ϣ��֪������B�ķ�ӦΪ�ӳɷ�Ӧ��BΪ![]() ��B����C�ķ�Ӧ�г�������C�����H2O��������������ȡ����Ӧ����E��EΪ
��B����C�ķ�Ӧ�г�������C�����H2O��������������ȡ����Ӧ����E��EΪ![]() ��
��![]() ����ȡ����Ӧ����F������G�ṹ��ʽ֪��������λȡ������FΪ
����ȡ����Ӧ����F������G�ṹ��ʽ֪��������λȡ������FΪ![]() ��F����ȡ����Ӧ���ɶ������������ݴ˷������
��F����ȡ����Ӧ���ɶ������������ݴ˷������
(1)����A�ķ�Ӧ��������ȥ��Ӧ��D�������ǶԱ������ᣬF�����������ŵ���������ԭ�ӡ�������
(2)B�Ľṹ��ʽ��![]() ����B��C���ķ�Ӧ�У���C�⣬����һ�ֲ�����H2O��
����B��C���ķ�Ӧ�У���C�⣬����һ�ֲ�����H2O��
(3)D+G��H�Ļ�ѧ����ʽ�ǣ�n![]() +n
+n![]()
![]() +(2n-1)H2O��
+(2n-1)H2O��
(4)DΪ![]() ��Q��D��ͬϵ���Է���������D��14�����ȡ����Ϊ��CH2COOH����COOH����3�ֽṹ�����ȡ����Ϊ��CH3��������COOH����6�ֽṹ�����ȡ����Ϊ��CH(COOH)2����1�֣��������������10�֣����к˴Ź���������4��壬�ҷ������Ϊ1��2��2��3�Ľṹ��ʽΪ
��Q��D��ͬϵ���Է���������D��14�����ȡ����Ϊ��CH2COOH����COOH����3�ֽṹ�����ȡ����Ϊ��CH3��������COOH����6�ֽṹ�����ȡ����Ϊ��CH(COOH)2����1�֣��������������10�֣����к˴Ź���������4��壬�ҷ������Ϊ1��2��2��3�Ľṹ��ʽΪ ��
�� ��
��
(5)CH2��CHCH��CH2��HC��CH�����ӳɷ�Ӧ����![]() ��
��![]() ���巢���ӳɷ�Ӧ����
���巢���ӳɷ�Ӧ���� ��
�� ����ˮ�ⷴӦ����
����ˮ�ⷴӦ���� ����ϳ�·��Ϊ��
����ϳ�·��Ϊ��![]()
![]()
![]()
![]()

![]()
 ��
��

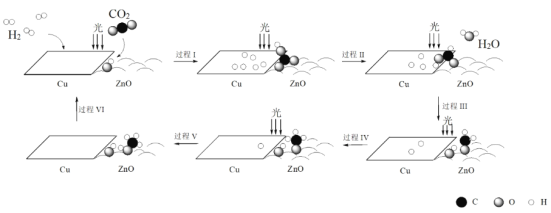
����Ŀ����.���淴Ӧ3A(g)![]() 3B(��)+C(��) ��H>0���ﵽ��ѧƽ��������в�����
3B(��)+C(��) ��H>0���ﵽ��ѧƽ��������в�����
��1�������¶ȣ��á������С�������䡱����ȷ������ա�
����B��C�������壬�����ƽ����Է�������___��
����B��C���������壬�����ƽ����Է�������___��
����B�����壬C�������壬�����ƽ����Է�������___��
��2�����ƽ����¶ȱ��ֲ��䣬�������������һ������ƽ��ʱA��Ũ����ԭ����50%���ж�B��״̬��___̬��C��״̬��__̬��
��3��ij�ܱ������з���һ������NO2��������Ӧ2NO2![]() N2O4������Ӧ���ȣ�����ƽ������ֱ��ı��������������´ﵽƽ�����ʹ�������ƽ���������������___��
N2O4������Ӧ���ȣ�����ƽ������ֱ��ı��������������´ﵽƽ�����ʹ�������ƽ���������������___��
A.ͨ��N2 B.ͨ��NO2 C.ͨ��N2O4 D.�����¶�
��.��һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��K ���¶�T�Ĺ�ϵ���±���ʾ��
CO(g)��H2O(g)���仯ѧƽ�ⳣ��K ���¶�T�Ĺ�ϵ���±���ʾ��
T/�� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��___��
��2���÷�ӦΪ___��Ӧ(����ȡ����ȡ�)��
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������___
A��������ѹǿ���� B�����������c(CO)����
C��v��(H2)��v��(H2O) D��c(CO2)��c(CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��[CO2]��[H2]��[CO]��[H2O]�����жϴ�ʱ���¶�Ϊ__�棻
��5��830�����������CO2 ��H2 �ﵽƽ���CO2 ��ת����Ϊ___��
��.���û�ѧ��Ӧԭ���о��ϳɰ���Ӧ����Ҫ���壬���������̽����
������������ˮ����ͨ�����ȵ�̿������ˮú����C(s)��H2O(g)![]() H2(g)��CO(g) ��H����131.3kJ��mol��1����S����133.7J��mol��1��K��1���÷�Ӧ�ڵ�����__(��ܡ����ܡ�)�Է����С�
H2(g)��CO(g) ��H����131.3kJ��mol��1����S����133.7J��mol��1��K��1���÷�Ӧ�ڵ�����__(��ܡ����ܡ�)�Է����С�