题目内容
下列基态原子或离子核外未成对电子数目为5的是
| A.Fe3+ | B.P | C.Cr | D.Cu |
A
解析试题分析:A.Fe3+的电子排布式为1s22s22p63s23p63d5,未成对电子数目为5,故A正确;B.P的电子排布式为1s22s22p63s23p3,未成对电子数目为3,故B错误;C.Cr的电子排布式为1s22s22p63s23p63d54s1,未成对电子数目为6,故C错误;D.Cu的电子排布式为1s22s22p63s23p63d104s1,未成对电子数目为1,故D错误.故选A.
考点: 考查核外电子排布的相关知识点。

练习册系列答案
相关题目
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图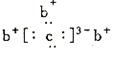 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a >c>d | B.非金属性:a >b>d |
| C.单质的熔点:c> a | D.最高价氧化物对应的水化物的酸性:c>d>a |
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
元素性质呈周期性变化的决定因素是
| A.元素原子半径大小呈周期性变化 | B.元素原子的原子序数依次增加 |
| C.元素的最高正化合价呈周期性变化 | D.元素原子最外层电子排布呈周期性变化 |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.原子半径的大小顺序为W>Q>Z>X>Y |
| B.元素X的气态氢化物与Q的单质可发生置换反应 |
| C.元素X与Y可以形成5种以上的化合物 |
| D.元素Q的最高价氧化物对应的水化物酸性比W的强 |
下列说法正确的是
| A.K能层中不包含p能级 | B.碳原子的电子排布式为1s22p4 |
| C.3p3表示3p能级有三个轨道 | D.同一原子中,2p、3p、4p能级的轨道数依次增加 |