题目内容
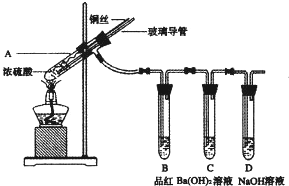
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如下图所示装置进行实验。

(1)实验过程中,观察到B中的实验现象是 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是 ,反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2. ;
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作、实验现象及结论。
限选试剂:KMnO4溶液、NaOH溶液、淀粉一KI溶液、KSCN溶液
|
实验操作步骤 |
实验现象 |
结论 |
|
|
|
|
(1)品红溶液褪色(2分),H2(2分)
(2)便于控制铁与浓硫酸的反应和停止(2分);从D管口向A中鼓入大量的空气(2分)
(3)①溶液中只存在Fe3+(1分)
②
|
实验操作 |
实验现象 |
结论 |
|
取A中溶液少量分别加入甲、乙两只试管中;甲中滴加少量酸性高锰酸钾溶液(1分);乙中滴加少量KSCN溶液(1分) |
甲中高锰酸钾溶液褪色(1分);乙中KSCN溶液不变红(1分) |
溶液中存在Fe2+(1分);不存在Fe3+(1分) |
【解析】
试题分析:(1)A中开始可能发生的反应有:2Fe+6H2SO4(浓)  Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3=3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3=3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
(2)将抽动的铁丝脱离液面,反应停止,将抽动的铁丝插入液面,反应开始;鼓入空气将试管内的气体排出。
(3)检验Fe2+时必须防止Fe3+的干扰,Fe3+与酸性高锰酸钾溶液不反应,而Fe2+具有较强的还原性,因此Fe2+能使酸性高锰酸钾溶液褪色,选择酸性高锰酸钾溶液。但必须还要证明溶液中不含Fe3+,选用KSCN溶液。
考点:以探究实验为基础,考查探究基本方法,物质的检验、氧化还原反应等相关知识。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
 (2012?开封一模)某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.
(2012?开封一模)某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.