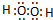题目内容
已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,A焰色呈浅黄色(透过兰色钴玻璃),E为黑色粉末,在下述转化中E均起催化作用(某些产物已略去)(如图1).

请回答:
(1)A的名称为 ;B的结构式为 ;
(2)已知A与某酸(含A中元素M)在一定条件下反应,产生气体单质X(含元素M).X能与液体B反应生成气体D,写出该反应的化学方程式: ;
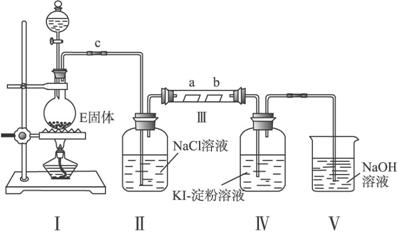
(3)某校化学兴趣小组为研究X单质的性质,设计如图2所示装置进行实验.装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
①加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处,然后向分液漏斗中加水,打开 ,一段时间后 ,则气密性良好;
②写出装置I中发生反应的离子方程式 ;
③实验过程中,装置Ⅳ中的实验现象为 ;
④实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象.为了达到这一实验目的,你认为应有 之间还需添加洗气瓶(选填装置序号),该装置的作用是 .

请回答:
(1)A的名称为
(2)已知A与某酸(含A中元素M)在一定条件下反应,产生气体单质X(含元素M).X能与液体B反应生成气体D,写出该反应的化学方程式:
(3)某校化学兴趣小组为研究X单质的性质,设计如图2所示装置进行实验.装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
①加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处,然后向分液漏斗中加水,打开
②写出装置I中发生反应的离子方程式
③实验过程中,装置Ⅳ中的实验现象为
④实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象.为了达到这一实验目的,你认为应有
分析:已知A、B、D、E四种物质中均含有同一种短周期元素,A焰色呈浅黄色(透过兰色钴玻璃),推断含有钾元素,D为气体单质,应为O2,E为黑色粉末,应为MnO2,根据物质的状态和反应条件下可知A为KClO3,B为H2O2,都可在MnO2作用下生成氧;
(1)依据推断得到A为KClO3,B为H2O2;过氧化氢分子结构是氧原子和氧原子形成一个共价键,每个氧原子和一个氢原子形成一个共价键;
(2)E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2;
(3)①依据装置中气体压强变化和分液漏斗中水的液面变化分析判断装置气密性;
②装置Ⅰ是暗示制备氯气的装置利用浓盐酸和二氧化锰加热反应生成氯气;
③氯气具有氧化性能氧化碘离子为碘单质,遇到淀粉变蓝;
④制备的氯气中含有水蒸气,需要增加一个装置除去水蒸气.
(1)依据推断得到A为KClO3,B为H2O2;过氧化氢分子结构是氧原子和氧原子形成一个共价键,每个氧原子和一个氢原子形成一个共价键;
(2)E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2;
(3)①依据装置中气体压强变化和分液漏斗中水的液面变化分析判断装置气密性;
②装置Ⅰ是暗示制备氯气的装置利用浓盐酸和二氧化锰加热反应生成氯气;
③氯气具有氧化性能氧化碘离子为碘单质,遇到淀粉变蓝;
④制备的氯气中含有水蒸气,需要增加一个装置除去水蒸气.
解答:解:(1)推断得到A为KClO3,B为H2O2;过氧化氢的结构式为:H-O-O-H,故答案为:氯酸钾;H-O-O-H;
(2)E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,气体Cl2能与溶液H2O2反应,生成气体O2,该反应的方程式为Cl2+H2O2=2HCl+O2,故答案为:Cl2+H2O2=2HCl+O2;
(3)①加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处,然后向分液漏斗中加水,打开分液漏斗旋塞,一段时间分液漏斗中的水不再流下证明装置气密性完好,
故答案为:分液漏斗的旋塞;分液漏斗中的水滴不下来;
②Ⅰ为制取氯气的发生装置,反应的方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
③氯气具有氧化性,与KI反应生成碘单质,淀粉遇碘变蓝色,故答案为:无色溶液变蓝色;
④为验证干燥的氯气不具有漂白性,则通入Ⅲ中的氯气应为干燥后的氯气,应装置II和III添加盛有浓硫酸的洗气装置,用以除去氯气中的水蒸气,
故答案为:II和III;除去氯气中的水蒸气或干燥氯气.
(2)E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,气体Cl2能与溶液H2O2反应,生成气体O2,该反应的方程式为Cl2+H2O2=2HCl+O2,故答案为:Cl2+H2O2=2HCl+O2;
(3)①加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处,然后向分液漏斗中加水,打开分液漏斗旋塞,一段时间分液漏斗中的水不再流下证明装置气密性完好,
故答案为:分液漏斗的旋塞;分液漏斗中的水滴不下来;
②Ⅰ为制取氯气的发生装置,反应的方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
③氯气具有氧化性,与KI反应生成碘单质,淀粉遇碘变蓝色,故答案为:无色溶液变蓝色;
④为验证干燥的氯气不具有漂白性,则通入Ⅲ中的氯气应为干燥后的氯气,应装置II和III添加盛有浓硫酸的洗气装置,用以除去氯气中的水蒸气,
故答案为:II和III;除去氯气中的水蒸气或干燥氯气.
点评:本题考查了无机物的推断以及性质实验的探究,题目难度中等,注意根据物质的原子结构特点和反应的转化关系推断各物质的种类,为解答该题的关键,本题侧重于物质的制备和性质探究,答题时要清楚实验原理和操作步骤.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 则:
则: