题目内容
【题目】I:磷酸氯喹是治疗新型肺炎的潜力药。磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。回答下列问题

(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图

①该反应的化学方程式为___________(A用化学式表示)
②前10s的平均反应速率v(Cl2)=_______
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是___________(写名称)
②A与热水反应的化学方程式为____________。
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图______________,并作相应标注(标明正负极材料及电解质溶液的名称,电子移动方向、离子移动方向)。
(2)该装置中负极的电极方程式为________。
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子__________mol。
【答案】2P+5Cl2=2PCl5 0.5mol/(Ls) 盐酸 PCl5+4H2O![]() H3PO4+5HCl
H3PO4+5HCl 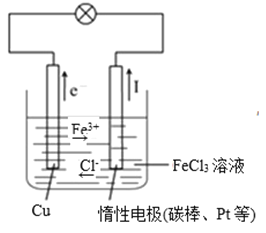 Cu-2e-=Cu2+ 0.1
Cu-2e-=Cu2+ 0.1
【解析】
I.合成磷酸的流程分析如下:红磷和氯气反应生成PCl5,PCl5再与水反应生成磷酸和盐酸;
II.将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,根据原电池的构成条件,应用铜作负极,正极比铜更稳定,如惰性电极,电解质为FeCl3溶液。
I(1)①A为PCl5,反应的化学方程式为2P+5Cl2=2PCl5,故答案为:2P+5Cl2=2PCl5;
②前10s的平均反应速率v(Cl2)=![]() =
= ![]() =0.5mol/(Ls),故答案为:0.5mol/(Ls);
=0.5mol/(Ls),故答案为:0.5mol/(Ls);
(2)①由上述分析可知,另一种是酸C是盐酸,故答案为:盐酸;
②PCl5与足量水充分反应,最终生成两种酸:磷酸和盐酸,由原子守恒可知化学方程式为PCl5+4H2O![]() H3PO4+5HCl,故答案为:PCl5+4H2O
H3PO4+5HCl,故答案为:PCl5+4H2O![]() H3PO4+5HCl;
H3PO4+5HCl;
II(1)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,则正极可为惰性电极,电解质溶液为氯化铁,装置示意图为: ,故答案为:
,故答案为: ;
;
(2)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)减轻的电极为Cu,电极减轻3.2g,则铜反应掉的物质的量为:![]() =0.05mol,则在导线中通过电子0.05mol
=0.05mol,则在导线中通过电子0.05mol![]() mol=0.1mol,故答案为:0.1。
mol=0.1mol,故答案为:0.1。

 学业测评一课一测系列答案
学业测评一课一测系列答案