题目内容
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中每个原子均满足8电子结构。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )
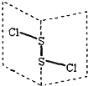
A. S2Cl2中的硫元素显+1价
B. S2Cl2中含极性键和非极性键,是非极性分子
C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D. S2Cl2与H2O反应的生成物中可能有S
【答案】B
【解析】
A.氯元素在S2Cl2中为-1价,根据化合价规则确定硫元素的化合价;
B.不同元素的原子之间形成的化学键多为极性键,由极性键构成的对称分子是非极性分子;
C.分子晶体中,分子量越大则熔沸点越高;
D.根据S2Cl2与H2O反应的化学方程式来回答。
A.氯元素在S2Cl2中为-1价,根据化合价规则知硫元素的化合价为+1价,A正确;
B.S-Cl键是极性键,S-S键是非极性键,由于分子中正负电荷的重心不能重合,所以分子是极性分子,B错误;
C. S2Cl2与S2Br2均属于分子晶体,分子晶体中,由于相对分子质量S2Br2>S2Cl2,相对分子质量越大,物质的熔沸点就越高,所以熔沸点:S2Br2>S2Cl2,C正确;
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,D正确;
故合理选项是B。

练习册系列答案
相关题目
【题目】如图所示是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是 ( )
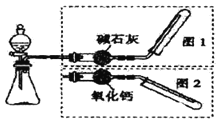
选项 | 发生装置中的药品 | 干燥和集气装置 | |
A | 饱和亚硫酸钠和浓硫酸 | 图2 | |
B | 大理石和稀盐酸 | 图1 | |
C | 铜和稀硝酸 | 图2 | |
D | 氧化钙和浓氨水 | 图1 | |
A.AB.BC.CD.D