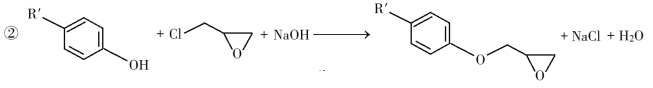
题目内容
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。
已知:①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③Q、X原子p能级的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是___;基态Q原子的价电子排布图为_____。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是____(填字母)。
a.稳定性:甲>乙 b.沸点:甲<乙
(3)Q、R、X三种元素的第一电离能数值由小至大的顺序为_____(用元素符号作答)。
(4)五种元素中,电负性最大的非金属元素是___,电负性最小的非金属元素是___。(用元素符号作答)。
【答案】1s22s22p63s23p63d9 ![]() ab C<O<N O Si
ab C<O<N O Si
【解析】
Z的原子序数为29,则Z为Cu元素;Q、R、X、Y均为短周期主族元素,Q、R、X、Y、Z五种元素的原子序数依次递增,Q、X的p轨道为2和4,则为Q为碳族元素,X为氧族元素元素;Y原子价电子(外围电子)排布msnmpn,s能级容纳电子数为2,则Y可能为C或Si,由于五种元素的原子序数依次递增,则Q为C元素、Y是Si元素;Q为C元素,X为O元素,R原子序数大于C元素,小于O元素,因此R为N元素,据此进行解答。
根据上述分析可知Q是C元素,R是N元素,X是O元素,Y是Si元素,Z是Cu元素。
(1)Z为Cu元素,Z2+为Cu2+,Cu的价电子排布为3d104s1,Cu原子失去两个电子变为Cu2+,则Cu2+的核外电子排布式是1s22s22p63s23p63d9。Q是C元素,核外电子排布式是1s22s22p2, 基态Q原子的价电子排布图为![]() ;
;
(2)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4,a正确;由于二者都是由分子构成的分子晶体,分子间通过分子间作用力结合,分子间作用力CH4<SiH4,分子间作用力越大,物质的熔沸点就越高,因此物质的沸点:CH4<SiH4,b正确;故合理选项是ab;
(3) Q、R、X三种元素分别是C、N和O,三种元素位于同一周期,一般情况下,同一周期的元素,原子序数越大,元素的第一电离能越大,但N原子最外层处于半充满的稳定状态,第一电离能大于同一周期相邻的元素的电离能,所以第一电离能C<O<N;
(4)元素的非金属性越强电负性越大,则电负性最大的非金属元素是O,最小的非金属元素是Si。

 金钥匙试卷系列答案
金钥匙试卷系列答案