题目内容
(16分)I.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
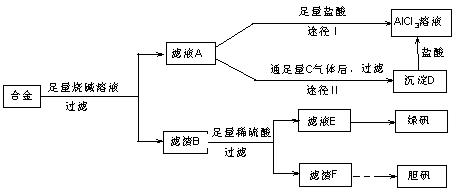
Ⅱ某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
试回答下列问题: &s.5*u.c.om
(1)用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是
 。
。
(3)从滤液E中得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式
。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
。
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
Ⅱ某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

试回答下列问题: &s.5*u.c.om
(1)用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是
 。
。(3)从滤液E中得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式
。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
。
Ⅰ①检查容量瓶是否漏水 (1分) ②玻棒、胶头滴管 (1分)
③环形玻璃搅拌棒 (1分) ④锥形瓶、滴定管夹(1分)
Ⅱ(1)漏斗、玻璃棒。(2分)
(2)途径Ⅱ更合理;(1分)因为滤液A是NaAlO2溶液,按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径II,通入c(CO2)气体,得D[Al(OH)3]沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径II更合理。(2分)
(3)蒸发浓缩、冷却结晶。(2分)
(4)2Cu + O2
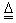 2CuO (1分) CuO + H2SO4 = CuSO4 + H2O,(1分)
2CuO (1分) CuO + H2SO4 = CuSO4 + H2O,(1分)CuSO4 + 5H2O = CuSO4·5H2O (1分)
(5)后者的方案不合理。因为该方案不符合实验方案设计的简约性原则,即操作步骤多、消耗试剂量更大、时间长。(2分)
略

练习册系列答案
相关题目
 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。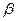 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。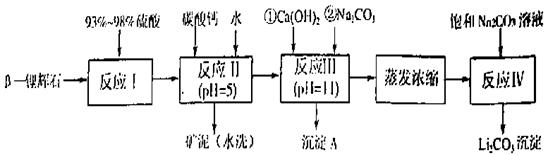
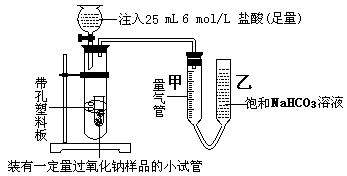
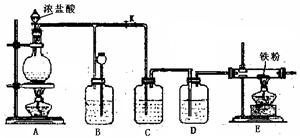
 (4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 ,B的作用是 。
(4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 ,B的作用是 。


