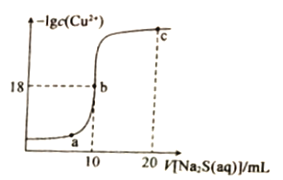
题目内容
【题目】T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
元素符号 | 元素性质或原子结构 |
T | 其一种无色氧化物遇空气变为红棕色 |
W | 其单质和化合物的焰色反应焰色均呈黄色 |
X | 基态原子的最外层电子排布式为 |
Y | 单质常温下为气体,可用于自来水消毒 |
Z | 一种核素的质量数为56,中子数为30 |
(1)Z元素位于周期表中第_ ______ 族,其基态原子的价层电子排布式为:______ ;
(2)T的一种化合物为![]() ,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
(3)W、X和Y三种元素中,第一电离能最小的为 ______ (填元素符号);W、X和Y的简单离子的半径从小到大的顺序为 ______ (用离子符号表示)。
(4)Z与水蒸气反应的化学方程式为:_____。
【答案】VIII ![]() 4:1 离子 Na
4:1 离子 Na ![]()
【解析】
T的某一种无色氧化物遇空气变为红棕色,为NO遇到氧气变成红棕色的二氧化氮,则T为N元素;W的单质和化合物的焰色均呈黄色,则W为Na元素;X的原子的最外层电子排布式为![]() ,
,![]() ,其最外层电子排布为:
,其最外层电子排布为:![]() ,则X为S元素;Y单质常温下为气体,可用于自来水消毒,则Y为Cl元素;Z的一种核素的质量数为56,中子数为30,Z的质子数
,则X为S元素;Y单质常温下为气体,可用于自来水消毒,则Y为Cl元素;Z的一种核素的质量数为56,中子数为30,Z的质子数![]() ,则Z为Fe元素。
,则Z为Fe元素。
![]() 为Fe元素,位于周期表中VIII族,Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:
为Fe元素,位于周期表中VIII族,Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:![]() ,价层电子排布式为:
,价层电子排布式为:![]() ,故答案为:VIII,
,故答案为:VIII,![]() ;
;
![]() 为N元素,则
为N元素,则![]() 为
为![]() ,N原子最外层5个电子,若要满足最外层达到8个电子,每个N原子需要形成3个共价键,其中氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为:
,N原子最外层5个电子,若要满足最外层达到8个电子,每个N原子需要形成3个共价键,其中氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为:![]() ,则
,则![]() 中存在1个非极性键、4个极性键,该分子中极性键和非极性键的数目之比为4:1;T为N元素,N的最低价氢化物为氨气,其最高价氧化物的水化物为硝酸,氨气与硝酸能发生化合反应生成硝酸铵,硝酸铵为离子晶体, 故答案为:4:1;离子;
中存在1个非极性键、4个极性键,该分子中极性键和非极性键的数目之比为4:1;T为N元素,N的最低价氢化物为氨气,其最高价氧化物的水化物为硝酸,氨气与硝酸能发生化合反应生成硝酸铵,硝酸铵为离子晶体, 故答案为:4:1;离子;
![]() 、X和Y三种元素分别为Na、S、Cl,同一周期中随着原子序数的递增,第一电离能呈减小趋势,则第一电离能最大的为Na;离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则三种离子大小为:
、X和Y三种元素分别为Na、S、Cl,同一周期中随着原子序数的递增,第一电离能呈减小趋势,则第一电离能最大的为Na;离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则三种离子大小为:![]() , 故答案为:Na;
, 故答案为:Na;![]() ;
;
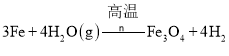
![]() 为Fe,铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:
为Fe,铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:![]()
![]()
![]() 。
。

【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 锌 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
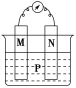
A.AB.BC.CD.D