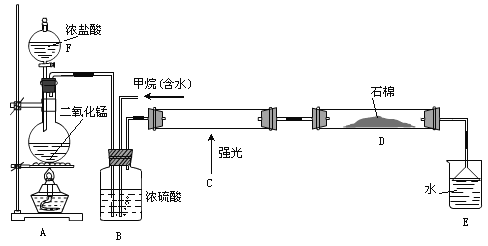
题目内容
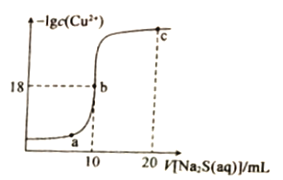
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
【答案】B
【解析】
A.根据物料守恒写出Na2S溶液中离子浓度之间的关系式;
B.b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)=c(S2-),据此进行分析;
C.CuCl2、Na2S均能水解促进水电离,氯化钠对水的电离平衡无影响;
D.c点溶液为NaCl和Na2S,根据原子守恒计算出n(Cl-)、n(Na+),从而得出结论。
A.根据物料守恒Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故A错误;
B.b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)=c(S2-),根据b点数据,c(Cu2+)=1×10-18mol/L,该温度下Ksp(CuS)=1×10-36,Ksp (CuS)的数量级为10-36,故B正确;
C.CuCl2、Na2S均能水解、促进水电离,b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离平衡没有影响,水的电离程度最小的为b点,故C错误;
D.c点溶液为NaCl和Na2S,根据原子守恒可知,n(Cl-)=10×0.1×2×10-3=2×10-3mol,n(Na+)=0.1×20×10-3×2=4×10-3mol,则 c点溶液中:2c(Cl-)=c(Na+),故D错误;
综上所述,本题选B。