题目内容
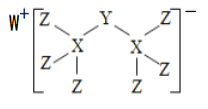
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
A. Y元素对应的最高价氧化物的水化物是强酸
B. 原子半径:X>Y>Z
C. 该新化合物中的Y元素不满足8电子稳定结构
D. Y、Z两元素可形成离子化合物
【答案】B
【解析】
W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IVA族,最外层有4个电子;Z位于第VIIA族,最外层7个电子;W形成+1价阳离子, W位于第IA族,最外层1个电子。Y的最外层电子数是其质子数的![]() ,若Y为第二周期元素,符合结构要求的为3号元素,与W元素冲突,故不为第二周期,若Y为第三周期元素,符合要求的为15号元素P,那么W为Na,X为Si,Z为Cl。
,若Y为第二周期元素,符合结构要求的为3号元素,与W元素冲突,故不为第二周期,若Y为第三周期元素,符合要求的为15号元素P,那么W为Na,X为Si,Z为Cl。
A. Y为P,Y的最高价氧化物的水合物是磷酸,为中强酸,故A错误;
B. 同周期元素从左至右,原子半径依次减小,原子半径:X>Y>Z,故B正确;
C. Y为P,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,即Y原子达到8电子结构,故C错误。
D. Y、Z两元素可形成三氯化磷、五氯化磷,为共价化合物,故D错误;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目