题目内容
20.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图(1)所示是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质物质的量随时间的变化曲线如图(2)所示.根据图中数据,试填写下列空白:
①该反应在2min时达到平衡状态;
②该反应的化学方程式为:3X+Y?2Z;
(3)一定温度下,对于反应2A(g)+B(g)?2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图(3)所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图所示.则:
①p点时反应的v正=v逆(填“>”、“<”或“=”);
②a,b两点的正反应速率va<vb(填“>”、“<”或“=”)
分析 (1)依据图象分析反应物能量高于生成物,反应是放热反应;
(2)依据图象分析XY为反应物,Z为生成物,反应在2min达XYZ物质的量不变说明到平衡状态,结合反应过程中消耗的物质的量计算反应比得到化学方程式;
(3)①由图象可知,反应进行到p点时,生成物C的物质的量不再变化,说明反应达到平衡状态,正逆反应速率相等;
②升高温度,C的物质的量减小,说明平衡向逆反应分析移动,则说明正反应放热,温度升高,反应速率增大,据此进行解答.
解答 解:(1)图象分析可知反应物能量高于生成物,反应的焓变=E1-E2,E1<E2,焓变为负值,反应是放热反应,
故答案为:放热;>;
(2)①图象分析可知反应进行到2min,X、Y、Z的物质的量不变,说明反应达到平衡状态,
故答案为:2;
②图象分析XY为反应物,Z为生成物,X在反应过程中消耗物质的量为:1.0mol-0,7mol=0.3mol,Y的消耗物质的量为:1.0mol-0.9mol=0.1mol,Z物质的量增大,增加的物质的量为0.2mol,则X、Y、Z物质的量之比为:0.3:0.1:0.2=3:1:2,
则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)①反应进行到p点时,生成物C的物质的量不再变化,说明反应达到平衡状态,正逆反应速率相等,
故答案为:=;
②结合图象可知,a、b两点时C的物质的量相同,则a、b两点时A、B的物质的量也一定相等,但是由于t2温度高于t1,则反应速率va<vb,
故答案为:<.
点评 本题考查物质的量随时间的变化曲线,题目难度中等,注意化学平衡的特征以及外界条件对化学平衡的影响,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.鉴别乙醇、丙三醇、乙醛、乙酸、甲酸、葡萄糖可以选用的一组试剂是( )
| A. | 金属钠和石蕊试剂 | B. | Na2CO3溶液和石蕊试剂 | ||
| C. | 酸性KMnO4和溴水 | D. | NaOH溶液和CuSO4溶液 |
11.能用热分解法制得的金属是( )
| A. | Fe | B. | Ag | C. | Mg | D. | Na |
8.在1,3-丁二烯合成氯丁橡胶的过程中,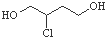 是一种中间产物,下列说法正确的是( )
是一种中间产物,下列说法正确的是( )
 是一种中间产物,下列说法正确的是( )
是一种中间产物,下列说法正确的是( )| A. | 1,3-丁二烯与氢气加成产物只有一种 | |
| B. | 1,3-丁二烯转化为 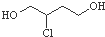 时,先与HCl发生1,2加成再水解得到 时,先与HCl发生1,2加成再水解得到 | |
| C. | 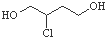 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 | |
| D. | 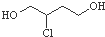 催化氧化得X,X能发生银镜反应,则X的结构只有两种 催化氧化得X,X能发生银镜反应,则X的结构只有两种 |
15.检验C3H7Br中是否含溴元素,其实验包括:
①加热
②加入用硝酸酸化的AgNO3溶液,观察是否产生浅黄色沉淀
③加入NaOH溶液
正确的操作顺序是( )
①加热
②加入用硝酸酸化的AgNO3溶液,观察是否产生浅黄色沉淀
③加入NaOH溶液
正确的操作顺序是( )
| A. | ①②③ | B. | ②①③ | C. | ③①② | D. | ③②① |
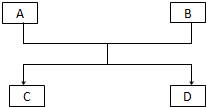 已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.
已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.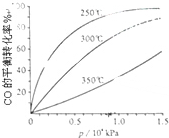 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.