题目内容
19.硝酸铵加热分解可得到N2O和H2O.250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数的表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.分析 依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,依据氧化还原反应得失电子守恒计算转移电子数.
解答 解:硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O+2H2O,250℃时,水为气体状态,NH4NO3为固态,
则平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,
故答案为:NH4NO3$\stackrel{△}{?}$N2O+2H2O;K=c(N2O)×c2(H2O);4.
点评 本题考查硝酸盐的性质、氧化还原反应,题目难度不大,侧重于基础知识的考查,根据元素化合价的变化分析.

练习册系列答案
相关题目
9.完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为5:2:1,则上述溶液的体积比为( )
| A. | 10:2:1 | B. | 5:2:1 | C. | 15:3:2 | D. | 15:3:1 |
14.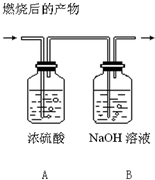 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )| A. | C2H2 | B. | C2H5OH 蒸汽 | ||
| C. | CH4 | D. | CH4与H2的混合气体 |
11.下列叙述正确的是( )
| A. | 6.02×1023个碳-12原子就是阿伏加德罗常数 | |
| B. | 1mol氧含6.02×1023个O2分子 | |
| C. | 1molCaCl2中含3mol离子 | |
| D. | 0.5molCl2含1mol氯 |
1.蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁实验步骤如下:

已知:
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)

已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)
