题目内容
16.已知NaN3与硝酸钾可以发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,NA表示阿伏加德罗常数的值.若还原产物所含的氮原子比氧化产物所含的氮原子少2.8mol,则下列判断正确的是( )| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中,只有N元素化合价发生变化,N元素的化合价分别由负价升高为0、由+5价降低为0,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,若还原产物所含的氮原子比氧化产物所含的氮原子少2.8mol,则生成3.2molN2,转移电子的物质的量为2mol,被氧化的N原子的物质的量为6mol,以此解答该题.
解答 解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中,只有N元素化合价发生变化,N元素的化合价分别由负价升高为0、由+5价降低为0,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,若还原产物所含的氮原子比氧化产物所含的氮原子少2.8mol,则生成3.2molN2,转移电子的物质的量为2mol,被氧化的N原子的物质的量为6mol,
A.由上述分析可知,被氧化的N原子为6mol,则2molNaN3被氧化,故A错误;
B.生成3.2molN2,被氧化的N原子的物质的量为6mol,由N原子守恒可知,被还原的N原子为3.2mol×2-6mol=0.4mol,数目为0.4NA,故B错误;
C.由上述分析可知,转移电子的物质的量为2mol,故C正确;
D.生成3.2molN2,其标况下体积为3.2mol×22.4L/mol=71.68L,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 6.02×1023个碳-12原子就是阿伏加德罗常数 | |
| B. | 1mol氧含6.02×1023个O2分子 | |
| C. | 1molCaCl2中含3mol离子 | |
| D. | 0.5molCl2含1mol氯 |
 氮的固定是指将氮元素由游离态转化为化合态的过程.
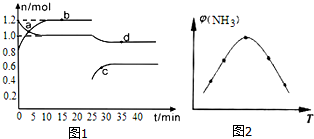
氮的固定是指将氮元素由游离态转化为化合态的过程.Ⅰ.(1)在容积固定且为2L的密闭容器中进行反应:
N2(g)+3H2(g)?2NH3(g),
恒温条件下,体系中某两种物质的物质的量随时间关系如图1,回答下列问题:
用H2表示15分钟内的反应速率为v(H2)=0.02mol/(L•min).
(2)实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
Ⅲ.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3,则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”),向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅳ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氨气的体积分数φ(N2)与反应温度T的关系曲线如图2所示,则上述反应的Q<0(填“>”、“<”或“=”).
