题目内容
下列各组原子序数表示的两种元素中,能够形成共价化合物的是( )
| A、11与17 | B、11与10 |
| C、1与17 | D、1与8 |
考点:共价键的形成及共价键的主要类型,原子结构与元素的性质
专题:化学键与晶体结构
分析:先根据原子序数判断原子的种类,然后根据非金属元素之间形成的化学键为共价键判断.
解答:
解:A、原子序数分别为11和17的元素分别为Na和Cl,形成的化合物为离子化合物,故A错误;
B、原子序数分别为11和10的元素分别为Na和Ne,Ne性质稳定与Na不反应,故B错误;
C、原子序数分别为1和17的元素分别为H和Cl,形成的化合物为共价化合物,故C正确;
D、原子序数分别为1和8的元素分别为H和O,形成的化合物为共价化合物,故D正确.
故选CD.
B、原子序数分别为11和10的元素分别为Na和Ne,Ne性质稳定与Na不反应,故B错误;
C、原子序数分别为1和17的元素分别为H和Cl,形成的化合物为共价化合物,故C正确;
D、原子序数分别为1和8的元素分别为H和O,形成的化合物为共价化合物,故D正确.
故选CD.
点评:本题考查离子键、共价键的判断,难度不大,注意二者成键条件的区别.

练习册系列答案
相关题目
下列分离混合物的操作中正确的是( )
| A、用分液的方法分离水和四氯化碳 |
| B、用分液的方法分离植物油和汽油 |
| C、用过滤的方法分离酒精和水 |
| D、用过滤的方法分离四氯化碳和碘 |
几种短周期元素的原子半径及主要化合价如下表:下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、Q2-比R3-更容易失去电子 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、M(OH)2的碱性比XOH的碱性强 |
2014年4月10日,兰州发生自来水苯含量超标事件.苯是石油化工的基本原料,苯进入人体内,可在造血组织本身形成有血液毒性的代谢产物,被世界卫生组织认定为致癌物质.下列关于苯的叙述正确的是( )
| A、苯环是单、双键交替组成的平面环状结构 | |||
| B、苯和乙烯均能使酸性KMnO4溶液褪色 | |||
C、苯的硝化反应: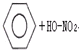
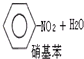 属于取代反应 属于取代反应 | |||
| D、苯跟溴水在催化剂作用下发生取代反应生成溴苯 |
下列物质中,属于合金的是( )
| A、金 | B、不锈钢 | C、金属铝 | D、铜 |
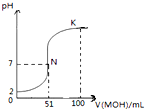 (1)常温下,将三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(1)常温下,将三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
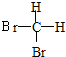 和
和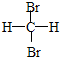 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应: 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化: