题目内容
【题目】硫酸性质是中学化学学习的重点。请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称: (写一种)。
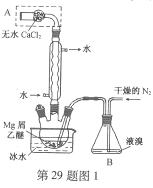
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。
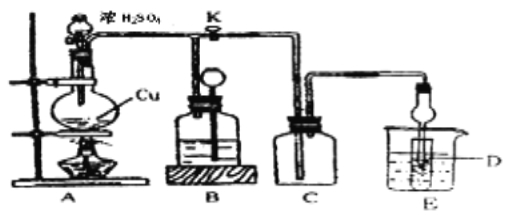
①装置B的作用是贮存多余的气体。B中应放置的液体是_______(填序号)
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是____(填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是_________。
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为 。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(3)利用FeCl3溶液的氧化性也可以吸收SO2。该反应的离子方程式是 。检验FeCl3是否完全被还原的方法为 。
【答案】(1)乙烯
(2)①d
②b
③2Cu+2H2SO4 +O2=2CuSO4+2H2O
④Ⅲ合理,Cl2+SO2+2H2O=4H++2Cl-+SO42-
c(Na+)=2 C(SO32-)+ C(HSO3-)
(3)2Fe3++SO2+2H2O=2Fe2++ SO42-+4H+
取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原
【解析】
试题分析:(1)乙醇在浓硫酸的催化作用下脱水生成乙烯,所以用浓硫酸还可制备乙烯气体。
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。
① Na2SO3溶液、酸性 KMnO4溶液、浓溴水都能和SO2反应,所以B中只能盛放饱和NaHSO3溶液,答案选d;
②BaCl2溶液能与硫酸铜反应生成硫酸钡沉淀,BaCl2溶液不能用来证明反应结束后的烧瓶中的确有余酸,答案选b;
③实验中某学生向A中反应后溶液中通入氧气,能使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是2Cu+2H2SO4 +O2=2CuSO4+2H2O。
④二氧化硫能被氯气氧化为硫酸、氯气被还原为盐酸, 向氯水中直接加入AgNO3溶液,也有白色沉淀生成;向第二份溶液加入品红溶液,红色褪去,氯水也能使品红褪色;向第三份溶液加入BaCl2溶液,产生白色沉淀,说明溶液中含有硫酸根离子,所以上述方案中合理的是Ⅲ;C中发生反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中,溶液中的离子有:Na+、SO32-、HSO3-、H+、OH-,根据电荷守恒,c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-),溶液显中性时,该溶液中c(Na+)=2c(SO32-)+ c(HSO3-)。
(3)该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++ SO42-+4H+。Fe3+能与KSCN反应,使溶液变为血红色,所以检验FeCl3是否完全被还原的方法为取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原。

 名校课堂系列答案
名校课堂系列答案【题目】某铁合金与铁的物理性质的比较如下表所示:
熔点(℃) | 密度(g /cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳