题目内容
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2是怎么样产生的? (用一句话说明)。
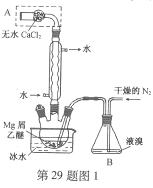
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是: 。
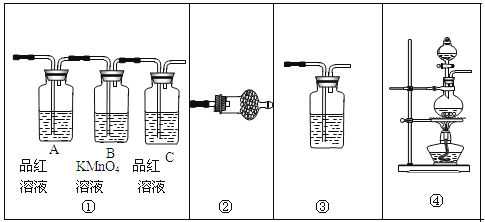
(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是______,B瓶的作用是______,C瓶的作用是______。
(4)装置②中所加的试剂名称是______,它可以验证的气体是______,简述确定装置②在整套装置中的位置的理由是___ ___。
(5)装置③中所盛溶液的名称是______,它可以用来验证的气体是______。
【答案】
(1)乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2;
(2) ④②①③;;
(3)检验是否有SO2;除去或吸收SO2;检验SO2是否除尽;
(4)无水硫酸铜;水蒸气; ①③导出的气体带有水蒸气,影响水蒸气的确定;
(5) 澄清的石灰水;CO2。
【解析】
试题分析:(1)浓硫酸有强氧化性,乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2;(2)二氧化硫是否存在可用品红溶液检验;检验二氧化碳可以用澄清石灰水溶液;检验水用无水硫酸铜。由于在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气,所以应先检验水蒸气的存在;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,二氧化碳的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用澄清石灰水实验检验二氧化碳,故装置连接顺序是④②①③;(3)二氧化硫是否存在可用品红溶液检验.二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,二氧化碳的检验应放在排除SO2的干扰后进行,先通过品红溶液褪色检验SO2的存在;再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,故A瓶的作用检验是否有SO2;B瓶的作用是除去或吸收SO2;C瓶的作用是检验SO2是否除尽;(4)装置②的作用是检验水的存在,检验水用无水硫酸铜,白色变为蓝色说明含有水蒸气;由于验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气,应最先用用无水硫酸铜检验水;(5)检验二氧化碳可以用澄清石灰水溶液,在排除二氧化硫的干扰后,澄清石灰水变浑浊,说明含有二氧化碳。

【题目】某铁合金与铁的物理性质的比较如下表所示:
熔点(℃) | 密度(g /cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳