题目内容
(1)如图甲所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化);当杠杆为导体时,A端比B端 .
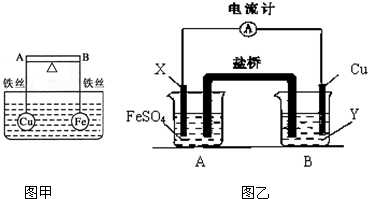
(2)依据氧化还原反应:Fe+Cu2+=Fe2++Cu设计的原电池如图乙所示,其中Y为可溶性硫酸盐.
请回答下列问题:
①电解质溶液Y是 ;(填分子式)
②X电极发生的电极反应为 ;
③装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是 ;
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 填(“原电池”或“电解池”).

(2)依据氧化还原反应:Fe+Cu2+=Fe2++Cu设计的原电池如图乙所示,其中Y为可溶性硫酸盐.
请回答下列问题:
①电解质溶液Y是
②X电极发生的电极反应为
③装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,电流计的指针
考点:设计原电池
专题:电化学专题
分析:(1)当杠杆为导体时,该装置构成原电池,铁作负极,铜作正极;
(2)原电池中,失电子的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的可溶性溶液为电解质溶液;原电池放电时,盐桥中阳离子向正极移动,阴离子向负极移动;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池.
(2)原电池中,失电子的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的可溶性溶液为电解质溶液;原电池放电时,盐桥中阳离子向正极移动,阴离子向负极移动;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池.
解答:
解:(1)当杠杆为导体时,该装置构成原电池,铁作负极,铜作正极,负极上铁失电子发生氧化反应,正极上析出铜,所以B短上升,A端下沉,即A端比B端低,
故答案为:低;
(2)①含有盐桥的原电池中,电极材料与电解质溶液中金属阳离子为同种元素,X为铁,则Y为硫酸铜溶液,
故答案为:CuSO4;
②X电极为铁,铁易失电子而作负极,电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
③盐桥中氯离子向负极电解质溶液移动,钾离子向正极电解质溶液移动,即钾离子向右侧烧杯移动、Cl-向左侧烧杯移动,所以B正确,
故答案为:B;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池,所以该装置中有电流产生,
故答案为:会;电解池.
故答案为:低;
(2)①含有盐桥的原电池中,电极材料与电解质溶液中金属阳离子为同种元素,X为铁,则Y为硫酸铜溶液,
故答案为:CuSO4;
②X电极为铁,铁易失电子而作负极,电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
③盐桥中氯离子向负极电解质溶液移动,钾离子向正极电解质溶液移动,即钾离子向右侧烧杯移动、Cl-向左侧烧杯移动,所以B正确,
故答案为:B;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池,所以该装置中有电流产生,
故答案为:会;电解池.
点评:本题以原电池和电解池原理为载体考查原电池的设计,题目难度中等,根据电池反应式中得失电子的情况确定电极材料及电解质溶液,明确原电池的构成条件是解本题关键.

练习册系列答案
相关题目
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① |
| B、下列原子的价电子排布中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,对应的第一电离能最大的是③ |
| C、某元素的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
| D、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ |
下列反应的离子方程式书写正确的是( )
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | ||||
B、电解饱和食盐水:2Cl-+2H2O
| ||||
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | ||||
| D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O |
已知葡萄糖(C6H12O6)的燃烧热是2804kJ?mol-1,当它被氧化生成1mol水时放出的热量是( )
| A、26.0kJ |
| B、51.9kJ |
| C、155.8kJ |
| D、467.3kJ |