题目内容
9.海水中蕴藏着丰富的资源,如图是从海水中提取Br2和Mg两种单质的主要步骤.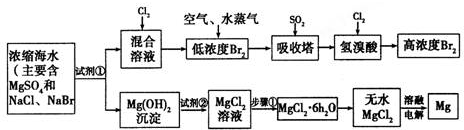
试回答:
(1)吸收塔中发生反应的离子方程式为Br2+SO2+2H2O═4H++SO42-+2Br-
(2)试比较Cl2,Br2,SO2三种物质的氧化性强弱Cl2>Br2>SO2(用“>”表示)
(3)试剂①,②分别是NaOH溶液、盐酸
(4)写出由无水MgCl2制取Mg的化学反应方程式MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
分析 由流程可知,加入试剂①生成Mg(OH)2沉淀,可知试剂①为NaOH,加试剂②生成氯化镁,则试剂②为HCl,电解熔融的无水MgCl2可制取Mg;加试剂NaOH反应后的混合溶液中含NaBr,加氯气发生Cl2+2NaBr=2NaCl+Br2,吸收塔中发生Br2+SO2+2H2O═4H++SO42-+2Br-,然后Cl2+2HBr=Br2+2HCl得到高浓度溴,以此来解答.
解答 解:由流程可知,加入试剂①生成Mg(OH)2沉淀,可知试剂①为NaOH,加试剂②生成氯化镁,则试剂②为HCl,电解熔融的无水MgCl2可制取Mg;加试剂NaOH反应后的混合溶液中含NaBr,加氯气发生Cl2+2NaBr=2NaCl+Br2,吸收塔中发生Br2+SO2+2H2O═4H++SO42-+2Br-,然后Cl2+2HBr=Br2+2HCl得到高浓度溴,
(1)由上述分析可知,吸收塔中发生反应的离子方程式为Br2+SO2+2H2O═4H++SO42-+2Br-,故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;
(2)由Cl2+2NaBr=2NaCl+Br2、Cl2+2HBr=Br2+2HCl、Br2+SO2+2H2O═4H++SO42-+2Br-,结合氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为Cl2>Br2>SO2,故答案为:Cl2>Br2>SO2;
(3)由上述分析可知,试剂①②分别为NaOH溶液、盐酸,故答案为:NaOH溶液、盐酸;
(4)由无水MgCl2制取Mg的化学反应方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应及混合物分离方法等为解答的关键,侧重分析与应用能力的考查,注意发生的氧化还原反应,题目难度不大.

 备战中考寒假系列答案
备战中考寒假系列答案| 序号 | 条件 | |
| 温度/℃ | 催化剂 | |
| 1 | 40 | FeCl3溶液 |
| 2 | 20 | FeCl3溶液 |
| 3 | 20 | MnO2 |
| 4 | 20 | 无 |
实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
实验中可以表明该反应速率差异的现象是产生气泡的快慢.
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023 | |
| C. | 欲配制1L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
| A. | 高温下,二氧化硅与氧化钙 | B. | 常温下,硅与氢氟酸溶液 | ||
| C. | 高温下,二氧化硅与碳酸钠固体 | D. | 常温下,二氧化硅与浓硝酸 |
| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用SO2漂白食品 |
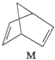 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$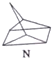 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1