题目内容
17.碳元素可以形成多种能源物质.请回答下列问题:(1)有机物M可转化为N,反应如下:
 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$ △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1M与N相比,较稳定的是M,在暗处反应的△H=-88.6kJ•mol-1.
(2)已知:CH3OH(1)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H=akJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=b kJ•mol-1
则a<b(填“>”,“<”或“=”)
(3)CH4燃烧热为890.3kJ•mol-1,写出表示CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol.
(4)工业上常以CO2(g)与H2(g)为原料合成乙醇.
反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1
则:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.7kJ•mol-1.
分析 (1)依据转化过程中M、N的能量高低分析判断,能量越高越活泼;可逆反应正逆反应的焓变大小相同符号相反;
(2)根据液态水转化成分气态水时要吸收热量分析;
(3)依据热化学方程式的书写方法,结合燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物时放出的热量写出,注意标注物质的聚集状态和燃烧热;
(4)a、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1;
b、2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1;
依据盖斯定律b-a×2计算得到.
解答 解:(1)转化过程是吸热反应,M的能量低于N,说明M稳定;在暗处反应即逆向进行,所以△H=-88.6kJ•mol-1,故答案为:M;-88.6kJ•mol-1;
(2)因为液态水转化成分气态水时要吸收热量,所以生成液态水放出的热量多,又放热焓变为负值,所以a<b,故答案为:<;
(3)CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ•mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(4)a、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1;
b、2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1;
依据盖斯定律b-a×2得到:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-173.7kJ•mol-1 ;
故答案为:-173.7kJ•mol-1 .
点评 本题考查了热化学方程式的书写和分析判断,燃烧热概念的应用,掌握基础是关键,题目难度中等.


则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2CO3 |
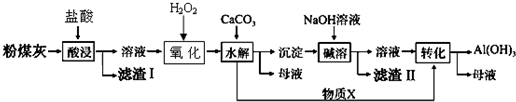
已知:①Cu2O+2H+=Cu+Cu2++H2O
②生成氢氧化物沉淀的pH:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)验证煤粉灰含有FeO必要的化学试剂为稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液).
(3)滤渣Ⅰ的主要成分为Cu、SiO2(填化学式),滤渣Ⅱ的主要成分为Fe (OH)3、Cu(OH)2(填化学式)
(4)物质X的化学式为CO2.“碱溶”时反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)为了获得产品Al(OH)3,从粉煤灰的盐酸浸取后的溶液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3_.
| A. | -CHO 羰基 | B. | -OH 羟基 | C. | -COOH 醛基 | D. | -NH2 硝基 |

| A. | 工作时,电解质溶液中K+向负极移动 | |
| B. | 电路若有0.4mol电子通过,则消耗O2的量为0.2mol | |
| C. | 一段时间后溶液中OH-浓度将升高 | |
| D. | 正极反应式为:O2+4e-+2H2O═4OH- |
| A. | 苯、乙烯分别使溴水褪色 | |
| B. | 溴乙烷分别在NaOH的水溶液、NaOH的醇溶液中反应 | |
| C. | 乙烯、甲苯使酸性KMnO4溶液褪色 | |
| D. | 苯、甲苯在一定条件下与混酸反应 |


 超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题:
超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题: