题目内容
在一个容积为V L的密闭容器中放入2 L A(g)和1 L B(g),在一定条件下发生下列反应3A(g)十B(g) 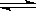 nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
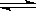 nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是| A.1 | B.2 | C.3 | D.4 |
A
略

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
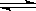 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下: A2(g)+3B2(g) ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是
A2(g)+3B2(g) ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是
 2N2O5(g);
2N2O5(g); ”或“不变”)
”或“不变”)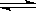 2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为 ;该条件下的反应的平衡常数为 。
2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为 ;该条件下的反应的平衡常数为 。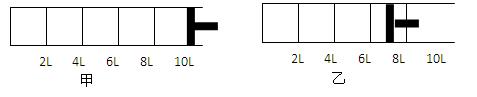
 体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)
体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g) XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
 pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是 体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p 化
化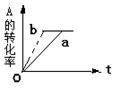
 3HF (正反应为吸热反应)
3HF (正反应为吸热反应)