题目内容
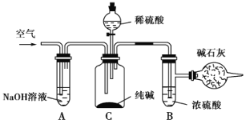
【题目】50mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)大小烧杯间填满碎泡沫塑料的作用___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是_________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_________(填“偏高”或“偏低”或“无影响”)。
(4)如果改用60mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__________(“增加”、“减少”或“不变”),理由是______________;所求中和热数值_______(“增加”、“减少”或“不变”),理由是_________________________。
【答案】 减少热量散失 不能 铜导热,会使热量散失 偏低 增加 生成H2O量增多 不变 因为中和热指的是生成1mol水时所放出的热量
【解析】(1)因为该实验中要尽可能的减少热量的损失,所以大小烧杯间填满碎泡沫塑料的作用减少实验过程中的热量损失。
(2)铜是热的良导体,易损失热量,所以不能将环形玻璃搅拌棒改为环形铜棒。
⑶大烧杯上如不盖硬纸板,则热量会损失,测定结果偏低。
(4)改变酸、碱的用量,则反应中放出的热量发生变化,但中和热是不变的,因为中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
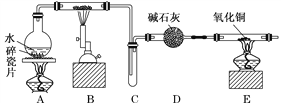
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。