��Ŀ����
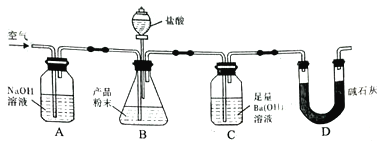
����Ŀ����ҵ�����г�����NaCl��Na2SO4�����ʣ���������ͼ��ʾ��װ�òⶨ��ҵ��������Ч�ɷֵĺ�����
ʵ����̵���Ҫ�����ǣ�
��ȷ��ȡ��������x g(x>2)��������ƿC�С�
��ȷ����װ�м�ʯ�ҵĸ���ܵ�����Ϊy g��
�۴ӷ�Һ©���л���ע��ϡ���ᣬ�����ٲ�������Ϊֹ��
�ܻ���������������ӣ�Ȼ�����ȡ�£�ȷ����������ΪW g��
��������ʵ�飬��д���пո�
(1)װ��A��������____________________________���������װ��A���ᵼ��ʵ����ƫ________(���С�����䡱����ͬ)��
(2)װ��B��������__________________���������װ��B���ᵼ��ʵ����ƫ________��
(3)ͨ�������������____________________�������ͨ��������ᵼ��ʵ����ƫ________��
���𰸡� ��ȥ�����е�CO2 �� ����ˮ�֣�����CO2 �� ʹ���ƿ����Na2CO3��H2SO4��Ӧ������CO2�ų� С
��������
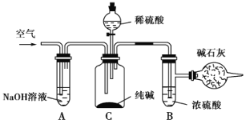
��ʵ��װ�ÿ���֪����A������������Һ�ɳ�ȥ�����еĶ�����̼��C��̼������ϡ���ᷴӦ���ɶ�����̼���������������������������C�����ɵĶ�����̼�����ų���B��Ũ�����������������ʯ�����ն�����̼���������ȡ����ȷ��������ΪW g����Ϊ������̼��������
(1)װ��A�������dz�ȥ�����еĶ�����̼���������װ��A,�����еĶ�����̼Ҳ������ʯ�ң�ʹWƫ����
(2)װ��B������������ˮ�������������̼���������װ��B��ˮ����Ҳ������ʯ�ң�Wƫ��,�ᵼ��ʵ����ƫ����
(3)ͨ�������������ʹ���ƿ�з�Ӧ�����Ķ�����̼�ų��������ͨ�������������̼������ȫ��������WƫС���ᵼ��ʵ����ƫС��