题目内容
11.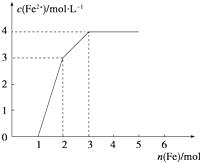 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)| A. | 1:1:1 | B. | 1:4:1 | C. | 3:3:8 | D. | 1:1:4 |
分析 依据氧化还原反应的顺序规律分析计算,溶液中含有Fe (NO3) 3、Cu (NO3) 2、HNO3,氧化性顺序为HNO3>Fe (NO3) 3>Cu (NO3) 2,加入铁后依次反应.
解答 解:稀溶液中各物质的氧化性顺序为HNO3>Fe(NO3)3>Cu(NO3) 2,加入铁后会依次发生氧化还原反应,
①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+;
从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;
再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;
再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;
综上所述可知原溶液中Fe (NO3) 3为1mol,Cu (NO3) 2物质的量为1mol,HNO3物质的量为4mol,稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为1:4:1;
故选B.
点评 本题考查了铁及其化合物的性质应用,主要考查氧化还原反应的顺序反应规律及计算应用.

练习册系列答案
相关题目
1.120℃、101kPa时,由两种烃组成的混合气体0.5L在4.5L O2中完全燃烧,测得反应后气体总体积小于5L,其中含CO2 0.8L,则生成水蒸气的体积为( )
| A. | 0.7L | B. | 1.0L | C. | 1.6L | D. | 2.5L |
2.(1)选择下列某种答案的序号,填入下表的空格
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
(2)现有下列各化合物:
A.CH3CH2CH2CHO与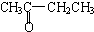 B.
B.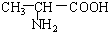 与
与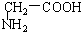 C.
C.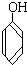 与
与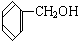
D.CH3CH2C≡CH与CH2═CH-CH=CH2E. 与
与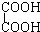 F、戊烯和环戊烷
F、戊烯和环戊烷
①上述化合物中的含氧官能团是(写名称)醛基;羰基;羧基;根据官能团的特点可将C中两化合物划分为酚类和醇类.
②若将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质 名称 | 红磷 与白磷 | 庚烷与 十六烷 | 氯仿与 三氯甲烷 | 氕与 氘、氚 | 2--甲基戊烷与 2,3--二甲基丁烷 |
| 相互 关系 |
A.CH3CH2CH2CHO与
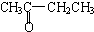 B.
B.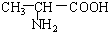 与
与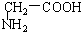 C.
C. 与
与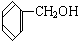
D.CH3CH2C≡CH与CH2═CH-CH=CH2E.
 与
与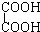 F、戊烯和环戊烷
F、戊烯和环戊烷①上述化合物中的含氧官能团是(写名称)醛基;羰基;羧基;根据官能团的特点可将C中两化合物划分为酚类和醇类.
②若将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
6.有机物M的结构简式如下:
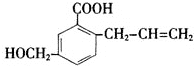
下列有关M的叙述不正确的是( )

下列有关M的叙述不正确的是( )
| A. | M的分子式为C11H1203 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | -定条件下,M能生成高分子化合物 | D. | 能发生加成反应不能发生取代反应 |
16.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
3.100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,取出该混合后的溶液10mL,则这10mL溶液中SO42-的物质的量浓度为( )
| A. | 0.20 mol/L | B. | 4mol/L | C. | 0.40 mol/L | D. | 6 mol/L |
20.下列叙述正确的是( )
| A. | 1mol任何气体的体积都约为22.4L | |
| B. | 标准状况下,氧气的体积约为22.4L | |
| C. | 在同温同压下,22g CO2与11.2L HCl含有相同的分子数 | |
| D. | 标准状况下,32g氧气的体积约是22.4L |
1.绿原酸的结构简式如图,下列有关绿原酸的说法错误的是( )
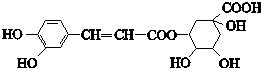
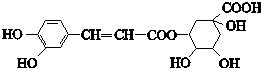
| A. | 分子式为C16H18O9 | |
| B. | 能与NaHCO3反应 | |
| C. | 能发生取代反应、氧化反应和消去反应 | |
| D. | 1 mol绿原酸最多与6 mol Br2反应 |