题目内容
20.下列叙述正确的是( )| A. | 1mol任何气体的体积都约为22.4L | |
| B. | 标准状况下,氧气的体积约为22.4L | |
| C. | 在同温同压下,22g CO2与11.2L HCl含有相同的分子数 | |
| D. | 标准状况下,32g氧气的体积约是22.4L |
分析 A.标准状况下,1mol气体的体积约为22.4L;
B.根据V=nVm计算气体的体积;
C、根据公式N=$\frac{m}{M}{N}_{A}$以及N=$\frac{V}{Vm}$NA来计算回答;
D、根据公式V=$\frac{m}{M}$Vm进行计算.
解答 解:A、标准状况下,1mol任何气体的体积都约为22.4L,故A错误;
B、标准状况下,不知道氧气的物质的量无法计算氧气的体积,故B错误;
C、标况下,22g CO2与11.2L HCl含有的分子数之比是:$\frac{22}{44}$:$\frac{11.2}{22.4}$=1:1,但是非标况下,分子数不相等,故C错误;
D、标准状况下,32g氧气的体积是$\frac{32g}{32g/mol}$×22.4L/mol=22.4L,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的概念、应用条件和正误判断,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
10.下列说法正确的是( )
| A. | 碱土金属元素是 IA 族元素 | B. | 被称为“生命元素”的是15号元素P | ||
| C. | 稀有气体元素都是非金属元素 | D. | 氕、氘、氚均可用做制造氢弹的原料 |
11.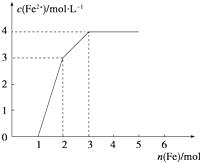 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)| A. | 1:1:1 | B. | 1:4:1 | C. | 3:3:8 | D. | 1:1:4 |
8.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将含有0.1 mol Ba(OH)2的溶液与含有0.2 mol NaHSO4的溶液混合:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 用Cu除去CuCl2溶液中的少量FeCl3:Cu+Fe3+═Cu2++Fe2+ |
15.下列各项中的“黄色”,不属于因化学反应而产生的是( )
| A. | 将钠在石棉网上加热熔化,冷却后得到淡黄色固体 | |
| B. | 食盐在无色的火焰上灼烧时,火焰呈黄色 | |
| C. | 久置的碘化钾溶液呈黄色 | |
| D. | 在氯化亚铁溶液中通入氯气,反应后得到黄色溶液 |
5.下列对相等物质的量的C3H6和C2H4的比较中正确的是( )
①所含的分子数目之比为1:1
②相同条件下体积之比为1:1
③所含的原子总数目之比为2:3
④相同条件下密度之比为14:21.
①所含的分子数目之比为1:1
②相同条件下体积之比为1:1
③所含的原子总数目之比为2:3
④相同条件下密度之比为14:21.
| A. | ①和③ | B. | ②和③ | C. | ①和② | D. | ③和④ |
12.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 1mol甲烷在光照条件下最多能与89.6L氯气反应 | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: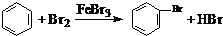 |
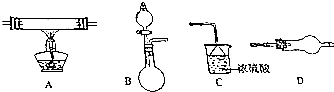 利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.
利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.