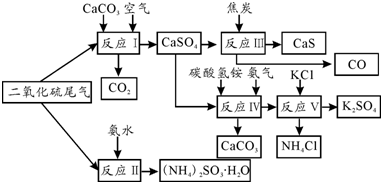
题目内容
16.下列关于电解质溶液的叙述正确的是( )| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
分析 A、pH=7的NH4Cl与氨水的混合溶液中c(H+)=c(OH-);
B、溶液稀释氢离子浓度减小,溶液中存在离子积常数,氢氧根离子浓度增大;
C、将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,醋酸是弱酸存在电离平衡,平衡状态下氢离子浓度和氢氧化钠溶液中氢氧根离子浓度相同,反应后醋酸又电离出氢离子溶液显酸性;
D、硫离子水解程度大于硫氢根离子水解程度,溶液碱性强.
解答 解:A、pH=7的NH4Cl与氨水的混合溶液中c(H+)=c(OH-),c(Cl-)=c(NH+4),溶液中离子浓度大小为:c(Cl-)=c(NH+4)>c(H+)=c(OH-),故A错误;
B、溶液稀释氢离子浓度减小,溶液中存在离子积常数,将pH=4的醋酸溶液稀释后,溶液中氢氧根离子浓度增大,故B错误;
C、将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,醋酸是弱酸存在电离平衡,平衡状态下氢离子浓度和氢氧化钠溶液中氢氧根离子浓度相同,反应后醋酸又电离出氢离子溶液显酸性,所得溶液的pH一定小于7,故C错误;
D、硫离子水解程度大于硫氢根离子水解程度,溶液碱性强,常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大,故D正确;
故选D.
点评 本题考查了离子浓度大小比较和弱电解质电离平衡的理解应用,主要是电解质溶液中电解质反应后的溶液酸碱性分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
6.取3mL 5mol.L-1H2 O2溶液,加入少量MnO2粉末,2min时c(H2O2)降为1mol/L.下列说法不正确的是( )
| A. | 2 min内,v(H2O2)=2 mol.L-1•min-l | |
| B. | MnOp是催化剂,能加快H2 O2的分解速率 | |
| C. | 升高温度或增大H2 O2的浓度,均能加快H2O2的分解速率 | |
| D. | 若将5 mol•L-1 H2O2溶液的体积增至6 mL,则H2O2的分解速率增至原来的2倍 |
4.反应C(s)+H2O(g)?CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
| A. | 增加水蒸气的量 | B. | 将容器的体积缩小一半 | ||
| C. | 保持体积不变,充入N2 | D. | 压强不变,充入N2使体积增大 |
11.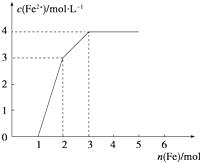 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)| A. | 1:1:1 | B. | 1:4:1 | C. | 3:3:8 | D. | 1:1:4 |
1.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| B. | 常温条件下c(H+)=10-12 mol•L-1的溶液:K+、SO42-、Cl-、Br- | |
| C. | 酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| D. | 紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
8.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将含有0.1 mol Ba(OH)2的溶液与含有0.2 mol NaHSO4的溶液混合:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 用Cu除去CuCl2溶液中的少量FeCl3:Cu+Fe3+═Cu2++Fe2+ |
5.下列对相等物质的量的C3H6和C2H4的比较中正确的是( )
①所含的分子数目之比为1:1
②相同条件下体积之比为1:1
③所含的原子总数目之比为2:3
④相同条件下密度之比为14:21.
①所含的分子数目之比为1:1
②相同条件下体积之比为1:1
③所含的原子总数目之比为2:3
④相同条件下密度之比为14:21.
| A. | ①和③ | B. | ②和③ | C. | ①和② | D. | ③和④ |
6.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2[c(HCO3-)+c(CO32?)+c(H2CO3)] | |
| B. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| C. | 0.1 mol•L-1Na2SO3溶液 c(H+)+c( Na+)=2c( SO32-)+c( OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |