题目内容
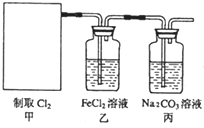
【题目】实验室通常采用以下装置来制备纯净干燥的氯气,回答下列问题:
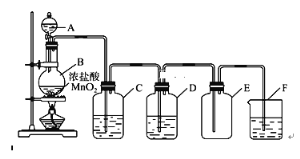
(1)写出实验室制备氯气的化学反应方程式:____________________________________。
(2)在反应中MnO2发生______(填“氧化”或“还原”,下同)反应,Cl2是______产物。
(3)装置C中所装试剂为________,其作用为_______________________________。
(4)检验氯气是否收集满的方法为:_________________________________________。
(5)F中反应的离子反应方程式为_________________________________________。
(6)工业上常用氯气与石灰水反应制备漂白粉,而久置漂白粉容易失效,请写出漂白粉失效的原理____________________________,_______________________________(用化学方程式表示)
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 还原 氧化 饱和食盐水 吸收Cl2中混有的HCl 在集气瓶口放置一片湿润的淀粉KI试纸,若试纸变蓝,则已收集满 Cl2+2OH-=Cl-+ClO-+H2O Ca(ClO)2+CO2=CaCO3↓+2HClO 2HClO
MnCl2+Cl2↑+2H2O 还原 氧化 饱和食盐水 吸收Cl2中混有的HCl 在集气瓶口放置一片湿润的淀粉KI试纸,若试纸变蓝,则已收集满 Cl2+2OH-=Cl-+ClO-+H2O Ca(ClO)2+CO2=CaCO3↓+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)实验室采用浓盐酸和二氧化锰制备氯气;
(2)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(3)根据氯气、氯化氢的性质分析;
(4)依据淀粉能使碘单质变蓝,而氯气的氧化性大于碘单质分析作答;
(5)氯气与氢氧化钠反应生成氯化钠和次氯酸钠,单质、水不能拆,据此书写离子反应方程式即可。
(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,实验室制备氯气的反应化学方程式为MnO2 + 4HCl(浓) = MnCl2 + Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)该反应中锰元素的化合价由+4价变为+2价,所以二氧化锰得电子作氧化剂,该反应中氯元素的化合价由-1价变为0价,所以氯化氢失电子作还原剂,得到的氯气是氧化产物,故答案为:还原;氧化;
(3)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,
故答案为:饱和食盐水;吸收Cl2中混有的HCl;
(4)氯气可将KI氧化为碘单质,碘单质遇淀粉变蓝,则检验氯气是否收集满的方法为:在集气瓶口放置一片湿润的淀粉KI试纸,若试纸变蓝,则已收集满,
故答案为:在集气瓶口放置一片湿润的淀粉KI试纸,若试纸变蓝,则已收集满;
(5)F为尾气吸收装置,盛装的是氢氧化钠溶液,氯气可以与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)制取漂白粉的使用的是氯气和消石灰,生成氯化钙和次氯酸钙、水,又漂白粉在空气中变质是因为其有效成分次氯酸钙与空气中的二氧化碳反应生成了次氯酸,并且次氯酸见光、受热分解,从而使漂白粉失效,即发生Ca(ClO)2+CO2=CaCO3↓+2HClO,2HClO![]() 2HCl+O2↑,
2HCl+O2↑,
故答案为:Ca(ClO)2+CO2=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑。
2HCl+O2↑。

 口算题天天练系列答案
口算题天天练系列答案