题目内容
【题目】(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题:
①在该反应中0.2mol高锰酸钾可得到1mol电子,该反应的还原产物为________(写化学式)
②请补全并配平该反应方程式:
___H2C2O4+ KMnO4+ H2SO4 → K2SO4+ + CO2↑ + H2O
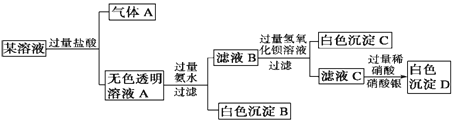
(2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:

根据实验现象回答:
该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。
【答案】MnSO4或Mn2+ 5;2;3;1;2MnSO4、10、8 Na+、CO32-、SO42-、Cl- Fe3+ K+
【解析】
(1)①依据氧化还原反应中氧化剂所含元素化合价降低解答;
②根据氧化还原反应中电子得失守恒解答;
(2)根据实验现象结合离子的性质分析解答。
(1)①草酸与高锰酸钾在酸性环境下发生反应,高锰酸钾做氧化剂被还原,在该反应中0.2mol高锰酸钾可得到1mol电子,+7价锰降价为+2价锰离子,还原产物为二价锰离子或者硫酸锰;
②该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,所以结合电子得失守恒、原子守恒配平方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;
(2)待测液加入KSCN溶液,无明显现象,则溶液中无三价铁离子,焰色反应呈黄色,说明含有钠离子,加入足量硝酸钡溶液产生白色沉淀,加入足量盐酸白色沉淀部分溶解说明沉淀为硫酸钡、碳酸钡混合物,则溶液中含有硫酸根离子、碳酸根离子,向加入足量硝酸钡溶液后过滤得到的滤液中加入硝酸酸化的硝酸银溶液产生白色沉淀为氯化银沉淀,则溶液中一定含有氯离子,通过已有事实无法确定是否存在钾离子,所以该溶液中一定含有的离子是Na+、CO32-、SO42-、Cl-;一定不含有的离子是Fe3+;无法确定的离子是K+。