题目内容
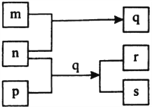
【题目】圣路易斯大学研制的新型乙醇燃料电池,使用能传递质子(H+)的介质作溶剂,反应原理为C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时,电流由a极沿导线经灯泡再到b极
C. 电池正极的电极反应为:4H++O2+4e-═2H2O
D. 电池工作时,1mol乙醇被氧化,则电路中有6mol电子转移
【答案】C
【解析】A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;C.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;D.乙醇中C元素的化合价为-2价,被氧化后升高到+4价,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误;故选C。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

【题目】近年来,我国机动车保有量持续增长,汽车尾气排放已成为城市的主要污染源,汽车尾气催化净化成为及其重要的环保产业。回答下列问题:
(1)用活性炭还原法可以处理汽车尾气中氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①第一次达平衡时,NO的转化率为_____________ ,T1℃时,该反应的平衡常数K=_______________。
②30min后只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________;
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol·L-1,则反应达平衡时c(NO)=________。
④若升高温度为T2℃,该反应是平衡常数K减小,原因是_______________。
(2)在汽车排气管加装催化转换器,可有效降低污染物的浓度。已知,催化转换器的效率计算:
ηi= ![]() ×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
温度/℃ | 流量/(m3·h-1) | CxHy/(106ppm) | CO/% | NOx/(106ppm) | |
入口 | 100 | 0.2 | 139 | 2.66 | 21 |
出口 | 31 | 0 | 0 |
①在上述条件下,η(CO)、η(NOx)均达100%,η(CxHy)=_____________。
②两种不同的催化剂JFG和HPA-8在不同温度、流量下CxHy的去除率如图所示:
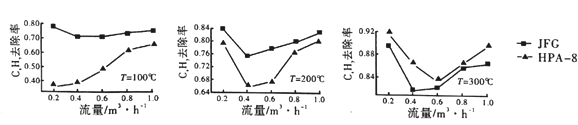
比较两种催化剂在不同温度下对CxHy的转化效率,由此可得出的结论是____________。