��Ŀ����
����Ŀ��25��ʱ��0.1 mol Na2CO3��ϡ���������õ����Ϊ1 L����Һ����Һ�в�������pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ����
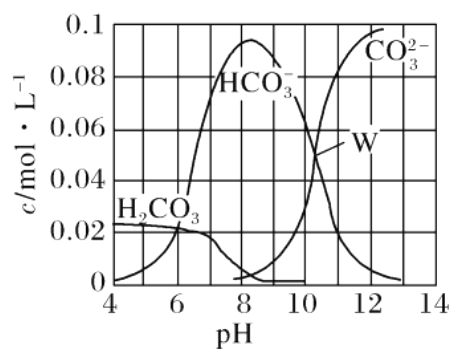
A. W����ʾ����Һ��c(Na��)>c(CO![]() )��c(HCO
)��c(HCO![]() )>c(OH��)>c(H��)
)>c(OH��)>c(H��)
B. pH��4����Һ��c(H2CO3)��c(HCO![]() )��c(CO
)��c(CO![]() )��0.1 mol��L��1
)��0.1 mol��L��1
C. ��pH��8����Һ��ͨ��CO2��pH��7���õ���Һ��c(Na��)>c(Cl��)��c(HCO![]() )��c(H2CO3)
)��c(H2CO3)
D. pH��11����Һ��c(Na��)��2c(H2CO3)>2c(Cl��)��2c(CO![]() )
)
���𰸡�AD
��������A������ͼ֪����Һ�д���CO32-��HCO3-�Ҷ��ߵ�Ũ����ȣ���Һ�в�����H2CO3��˵����Һ������Ϊ̼���ơ�̼�����ƣ����߶�ˮ�����Һ�ʼ��ԣ�����ˮ��̶Ƚ�С�������Ӳ�ˮ�⣬����Һ�д��ڣ�c��Na+����c��CO32-��=c��HCO3-����c��OH-����c��H+������A��ȷ��B��pH=4ʱ����Һ�в�����CO32-�����������غ�ã�c��H2CO3��+c��HCO3-��=0.1molL-1����B����C����pH=8����Һ��ͨ��CO2��pH=7����Һ��c��OH-��=c��H+������Һ�в�����CO32-�����ݵ���غ��c��Na+��=c��Cl-��+c��HCO3-��������c��Na+����c��Cl-��+c��HCO3-��+c��H2CO3������C����D������ͼ֪��pH=11ʱ��Һ��c��H2CO3��=0����Һ��c��Na2CO3����0.08mol/L��c��NaHCO3����0.02mol/L����Ϊ��ӦNa2CO3+HCl=NaHCO3+NaCl����Ϊ̼����ˮ��̶ȴ���̼�����Ƶ���̶ȣ����Եõ�����Һ��c��NaHCO3����c��NaCl������c��Cl-����c��HCO3-������Һ�ʼ��ԣ���ϵ���غ��c��Na+����c��Cl-��+2c��CO32-��+c��HCO3-������Ϊc��Cl-����c��HCO3-�������Դ���c��Na+��+2c��H2CO3����2c��Cl-��+2c��CO32-������D��ȷ����ѡAD��

 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�����Ŀ��3��5-����������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɡ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£��� ��

���� | �е�/�� | �۵�/�� | �ܽ��� |
�״� | 64. 7 | ��97.8 | ������ˮ |
3��5-������������ | 172~175 | 33~36 | �����ڼ״������ѣ�����ˮ |
����˵����ȷ���ǣ� ��
A. ������״��IJ����ǽᾧ B. �䱽�����뱽�ӻ�Ϊͬϵ��
C. �����ϳɷ�Ӧ����ȡ����Ӧ D. ϴ��ʱ�����ñ���Na2CO3��Һ���Ȼ���
����Ŀ���ϲ��뺣�����ƣ���һ�ָ��������ĺ���ֲ���Ʒ�ϲ��ᱡ�ɴࡢ�Ⱥ������ױ����ճɻң���ʱ��ת��Ϊ�⻯�����Σ������ڵⵥ�ʵ���ȡ����֪:
�ҽ� | ���Ȼ�̼ | �ѻ����� | �⣨���壩 | |
�ܶ�gcm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
�е�/�� | 78.5 | 76.8 | 25~232 | 184.35 |
����Ϊij��ȤС��ģ����ϲ���ȡ�ⵥ�ʵĹ��̣�
![]()
(1)ʵ���ұ����ϲˣ���Ҫ���������е�___________������ţ���
a.�Թ� b.�ձ� c.���� d.������ e.������ f.�ƾ��� g.ȼ�ճ�
(2)���������õ��ϲ˻���������˫��ˮ��ϡ�������ã�д����Ӧ�����ӷ���ʽ___________��
(3)�����ٵ�������__________���Լ�AΪ_________ (��������һ����ѻ�ѧ�Լ������ƣ�����ʹ�����������Լ�����Ҫԭ��ֱ��ǣ�I_____________________��II __________________��
(4)������Ӧ��____________(�������ƣ��������ã��۲쵽��������______________��
(5)�÷������ó�ѹ��������������������____________________��


