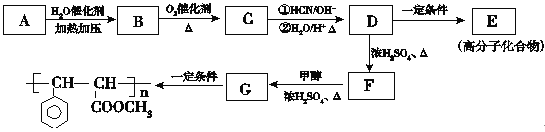
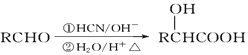题目内容
【题目】下列有关说法正确的是
A. 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同
B. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
C. 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D. 已知I![]()
![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
【答案】AC
【解析】A.醋酸钠水解促进水的电离,氢氧化钠溶液是强碱抑制水的电离,电离程度不同,故A正确;B.反应能自发进行说明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知该反应的<0,要使:△H-T△S<0,所以必须满足△H<0,故B错误;C.逐滴加入氨水,首先生成蓝色沉淀,则溶度积小的Cu(OH)2先沉淀,则Ksp[Cu(OH)2]<Ksp[Mg(OH)2],故C正确;D.碘单质溶于CCl4层显紫色,不是KI3,故D错误;答案为AC。

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目