题目内容
8.在1000K恒温下,在密闭容器中发生反应:A(g)+3B(g)?2C(g),并达到平衡.测得其平衡时的浓度分别为:[A]=2mol/L,[B]=5mol/L,[C]=3mol/L,求:(1)起始时A、B的物质的量浓度$\frac{1}{3}$<[A]<3.5;0<[B]<9.5;
(2)同温下将压强增大一倍,通过平衡常数的计算,说明平衡移动的方向K>Qc,平衡正向移动.
分析 (1)利用极端建设法,全部正向反应完全和假设逆向反应完全求算;
(2)压强增大1倍,各组分浓度增大1倍,计算Qc与K比较.
解答 解:(1)假设开始加入的是A与B,则A为2mol/L+1.5mol/L=3.5mol/L,B为5mol/L+4.5mol/L=9.5mol/L,假设全部正向反应完全,则B为0时,A为2-$\frac{5}{3}$=$\frac{1}{3}$mol/L,
故答案为:$\frac{1}{3}$<[A]<3.5;0<[B]<9.5;
(2)压强增大1倍,各组分浓度增大1倍,Qc=$\frac{{6}^{2}}{4×1{0}^{3}}$=0.009,K=$\frac{{3}^{2}}{2×{5}^{3}}$=0.06,K>Qc,平衡正向移动,故答案为:K>Qc,平衡正向移动.
点评 本题考查了平衡浓度的计算以及根据Qc和K的大小,判断平衡移动的方向,题目难度不大.

| A. | 升华 溶解 过滤 蒸发 | B. | 溶解 过滤 萃取 分液 | ||
| C. | 加热 溶解 过滤 结晶 | D. | 溶解 过滤 分馏 结晶 |
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCl的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+),c(Cl-)均会减小 |
元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y |
|
| Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
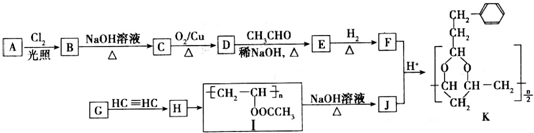
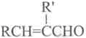 +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)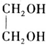 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$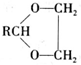 +H2O
+H2O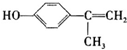 (写结构简式).
(写结构简式).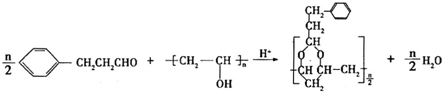 .
.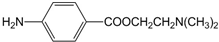 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):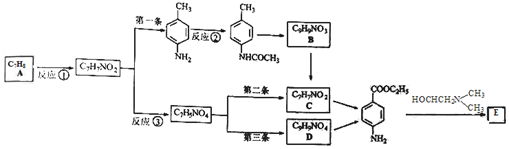
 ;C的名称是对氨基苯甲酸.
;C的名称是对氨基苯甲酸.
