题目内容
1.能证明SO2中混有CO2的方法是( )| A. | 通过品红溶液 | |
| B. | 通过澄清石灰水 | |
| C. | 先通过高锰酸钾溶液,再通过澄清石灰水 | |
| D. | 先通过澄清石灰水,再通过高锰酸钾溶液 |
分析 均为酸性氧化物,都为弱酸的酸酐;能与Ca(OH)2、Ba(OH)2等碱生成白色沉淀,而SO2具有漂白性与还原性,而CO2不具有,以此来解答.
解答 解:A.品红溶液检验的是二氧化硫,不能说明混有CO2,故A错误;
B.CO2+Ca(OH)=CaCO3↓+H2O,SO2+Ca(OH)=CaSO3↓+H2O,不能验证有无CO2,故B错误;
C.先通过高锰酸钾溶液,KMnO4酸性溶液将SO2完全吸收,再通过澄清石灰水若有白色沉淀一定有CO2,若无沉淀则无CO2,故C正确;
D.先通过澄清石灰水,由选项B可知,两种气体均可被吸收,不能检验,故D错误;
故选C.
点评 本题考查物质的检验,为高频考点,把握物质的性质、性质差异为解答的关键,侧重元素化合物性质及应用能力的考查,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
11.设NA代表阿伏加德罗常数的数值,下列说法中正确的是;( )
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
12.下列说法正确的是( )
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 | |
| D. | 室温下,浓度均为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
9.共价键、离子键和范德华力是构成物质时粒子间的不同作用力,下列物质中,只含有上述一种作用力的是( )
| A. | 干冰 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
16.下列物质不属于同素异形体的是( )
| A. | 金刚石和石墨 | B. | 水晶和石英 | C. | 红磷和白磷 | D. | C60和金刚石 |
13.有八种物质:①甲烷 ②苯 ③聚乙烯 ④乙烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③⑤⑧ | B. | ④⑤⑦ | C. | ④⑤⑧ | D. | ⑤⑦⑧ |
10.侧链上含3个碳原子的甲苯的同系物共有( )
| A. | 1种 | B. | 3种 | C. | 6种 | D. | 8种 |
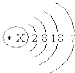 已知溴原子的原子结构示意图如图﹕
已知溴原子的原子结构示意图如图﹕