题目内容
16.下列反应中,氨气体现还原性,且既有极性共价键、非极性共价键的断裂和形成是( )| A. | NH3+HCl═NH4Cl | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 2NH3+2Na═2NaNH2+H2 | D. | 2NH3+3CuO═3Cu+N2+3H2O |
分析 还原性是指元素的化合价升高的性质,不同的非金属原子之间形成的化学键是极性共价键、相同的金属原子之间形成的化学键是非极性共价键.
解答 解:A、氨气和氯化氢反应生成氯化铵的反应中,没有元素的化合价升降,不是氧化还原反应,氨气没有体现还原性,故A错误;
B、8NH3+3Cl2═6NH4Cl+N2中N元素的化合价升高,氨气体现还原性,Cl-Cl键、N-H键断开,氮氮三键、N-H配位键生成,故B正确;
C、2NH3+2Na═2NaNH2+H2中N元素的化合价不变化,没有表现还原性,故C错误;
D、2NH3+3CuO═3Cu+N2+3H2O中N元素的化合价升高,氨气体现还原性,但是没有非极性共价键的断裂,故D错误.
故选B.
点评 本题考查学生物质的组成元素和化学键之间的关系知识,注意化学键的判断是关键,难度中等.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
6.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | CCl4 | B. | BF3 | C. | HClO | D. | H2O |
7.下列各组中能互称为同位素的是( )
| A. | D和T | B. | H2和D2 | C. | 金刚石和石墨 | D. | N≡N和N2 |
11.下列有关说法正确的是( )
| A. | 反应2NO2═N2O4在室温下可自发进行,则该反应的△H<0 | |
| B. | 工业上电解熔融态氯化铝冶炼单质铝 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
8.理论上不能设计为原电池的化学反应是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | HNO3+NaOH═NaNO3+H2O | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2FeCl3+Fe═3FeCl2 |
5.用CaCO3与稀盐酸反应制取CO2,部分时间段内产生气体的体积如图所示,下列说法正确的是:( )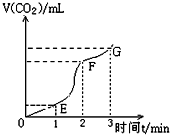

| A. | OE段化学反应速率最快 | |
| B. | EF段收集CO2气体最多 | |
| C. | 为了加快反应速率,可向溶液中滴入硫酸铜溶液 | |
| D. | 分析OE、EF、FG三段,该反应为放热反应 |
6.下列化学式既能表示物质的组成,又能表示物质分子式的是( )
| A. | NH4NO3 | B. | SiO2 | C. | C5H10 | D. | Fe |